
科目: 来源: 题型:选择题
| A. | Mg2+ | B. | Mg2+、Fe2+ | C. | Fe2+ | D. | Mg2+、Al3+ |
查看答案和解析>>
科目: 来源: 题型:推断题
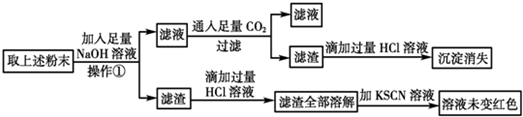
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | NO2+NO+2NaOH═2NaNO2+H2O | |
| C. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O | |
| D. | CuO+H2SO4(稀)═CuSO4+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
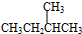 与
与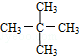 G.
G.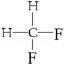 与
与 
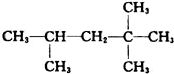 ,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:CH3C(CH3)2C(CH3)2CH3;若A是由烯烃和H2通过加成反应得到,则该烯烃的所有可能的结构简式为
,它是汽油燃烧品质抗震性能的参照物,其中A的同分异构体中含等效氢原子种类最少的一种结构简式为:CH3C(CH3)2C(CH3)2CH3;若A是由烯烃和H2通过加成反应得到,则该烯烃的所有可能的结构简式为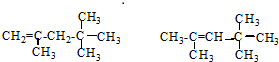 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 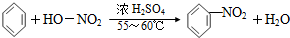 | |
| B. |  | |
| C. | 2 CH3CH2OH+O2 $→_{△}^{催化剂}$ 2 CH3CHO+2 H2O | |
| D. | CH2=CH2+HCl→CH3CH2Cl |
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为 ①氢气 |
| 实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量 ②稀盐酸 | ③产生气泡沉淀全部溶解 | 白色不溶物可能含有猜测2中不溶物 |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 ④CO32- |
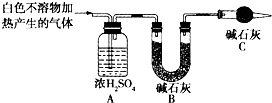
查看答案和解析>>
科目: 来源: 题型:填空题
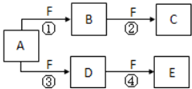 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示:
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示: .
.查看答案和解析>>
科目: 来源: 题型:推断题
| 元素 | 部分结构特点 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14 个电子 | X有多种氧化物,如XO、XO2等 |
| Y | Y原子的次外层电子数等于最外层电子数 的一半 | Y元素能形成多种单质 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价的代数和等于6 |
| W | 第三周期元素的简单离子中半径最小 | W的单质化学性质虽较活泼,但只需常温保存 |
 .
.查看答案和解析>>
科目: 来源: 题型:填空题
 ①~⑧是元素周期表中前四周期的8种元素,其相对位置如图所示.
①~⑧是元素周期表中前四周期的8种元素,其相对位置如图所示. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com