
科目: 来源: 题型:填空题
| 粒子 | I2 | Br2 | IO |
| 物质的量/mol | 0.5 | 1.3 |
查看答案和解析>>
科目: 来源: 题型:填空题
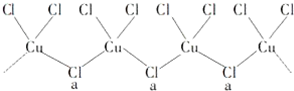
查看答案和解析>>
科目: 来源: 题型:填空题

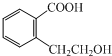
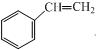
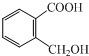
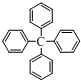
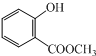
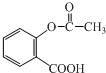
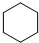
查看答案和解析>>
科目: 来源: 题型:推断题
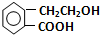 ,它可通过不同化学反应分别制得B、C、D三种物质.
,它可通过不同化学反应分别制得B、C、D三种物质.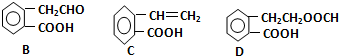
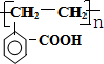 .
. .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
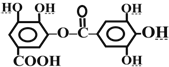
| A. | 该有机物的分子式为C14H10O9 | |
| B. | 常温下,与Na2CO3溶液反应放出CO2 | |
| C. | 与稀H2SO4共热,生成两种有机物 | |
| D. | 能发生碱性水解,1mol该有机物完全反应消耗8molNaOH |
查看答案和解析>>
科目: 来源: 题型:选择题
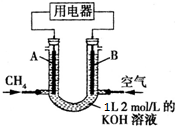
| A. | 通入CH4的一端为原电池的负极,溶液中OH-向负极区移动 | |
| B. | 当0<V≤22.4L时,电池总反应式为CH4+2O2+2KOH═K2CO3+3H2O | |
| C. | 当22.4L<V≤44.8L时,负极电极反应为CH4-8e-+9CO32-+3H2O═10HCO3- | |
| D. | 当V=33.6L时,溶液中阴离子浓度大小关系为c(CO32- )>c(HCO3-)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:实验题
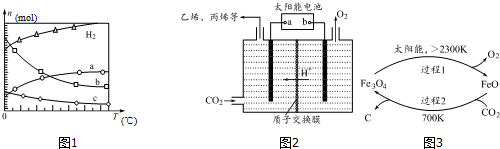
查看答案和解析>>
科目: 来源: 题型:解答题
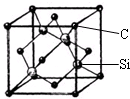 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
科目: 来源: 题型:解答题
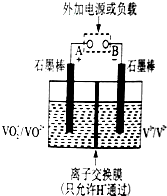 钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用.回答下列问题:
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com