
科目: 来源: 题型:多选题
| A. | 1mol羟基和lmol氢氧根离子所含的电子数均为10NA | |
| B. | 0.lmol/L乙酸溶液中所含醋酸根离子的数目小于0.1NA | |
| C. | 当合成氨反应达到平衡时,表明每生成6NA个N-H键的同时必生成3NA个H-H键 | |
| D. | 46g由NO2和N2O4组成的混合气体中所含的原子数为3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 食品添加剂可分为着色剂、调味剂、防腐剂和营养强化剂等 | |
| B. | “是药三分毒”,因此,有病不能服药 | |
| C. | 加碘盐即为加入少量单质碘的食盐 | |
| D. | 人体的功能物质只有糖类和油脂 |
查看答案和解析>>
科目: 来源: 题型:解答题
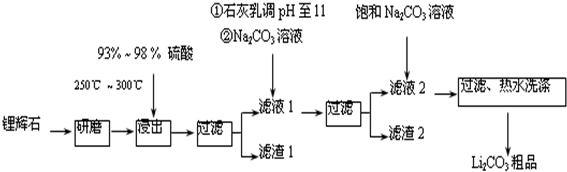
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
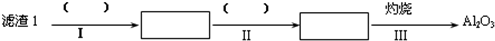
查看答案和解析>>
科目: 来源: 题型:实验题
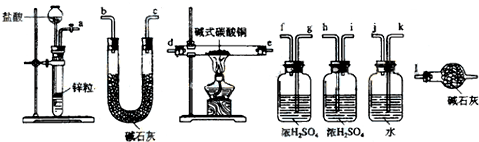
查看答案和解析>>
科目: 来源: 题型:填空题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
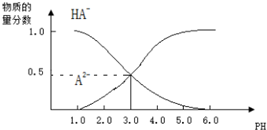
| A. | H2A的电离方程式为:H2A?H++HA-,HA-?H++A2- | |
| B. | 0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L | |
| C. | 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0 | |
| D. | pH=4.0时,图中n(HA-)约为0.0091mol |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com