
科目: 来源: 题型:选择题
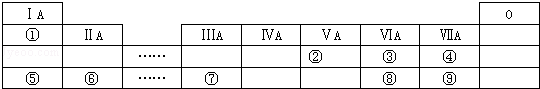
| A. | ①③⑤ | B. | ①②③ | C. | ①②③⑥ | D. | ②③⑥ |
查看答案和解析>>
科目: 来源: 题型:实验题
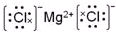 .
.
查看答案和解析>>
科目: 来源: 题型:实验题
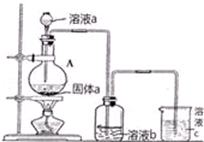
 如图所示为相互串联的甲、乙两电解池.试回答:
如图所示为相互串联的甲、乙两电解池.试回答:查看答案和解析>>
科目: 来源: 题型:推断题
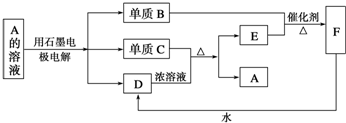
查看答案和解析>>
科目: 来源: 题型:解答题
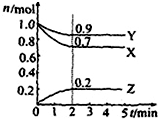 某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目: 来源: 题型:解答题
 依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Zn(s)═Zn2+(aq)+2Ag(s) 设计的原电池如图所示.查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃 | |
| B. | 分子组成符合CnH2n+2的烃一定是烷烃 | |
| C. | 烷烃分子中所有的碳原子均在同一条直线上 | |
| D. | 烷烃分子中每个碳原子处于正四面体的中心 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 纯碱溶液显碱性:CO32-+2H2O?H2CO3+2OH- | |
| B. | 醋酸溶液显酸性:CH3COOH+H2O?CH3COO-+H3O+ | |
| C. | 向碘化亚铁溶液中通入足量的溴水:3Br2+2Fe2++4I-═6Br-+2Fe3++2I2 | |
| D. | 向碳酸氢钙溶液中滴加过量的烧碱溶液:HCO3-+Ca2++2OH-═CaCO3↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com