
科目: 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应OH-+H+═H2O | |
| B. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 金属钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠在常温下很容易被氧化 | B. | 钠在空气中燃烧生成Na2O | ||
| C. | 钠燃烧时发出黄色的火焰 | D. | 钠的密度比水小,熔点低于100℃ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸硫酸 H2SO3 | B. | 酸性氧化物干冰 CO | ||
| C. | 碱性氧化物氧化钙 CaO | D. | 盐苏打 NaHCO3 |
查看答案和解析>>
科目: 来源: 题型:实验题

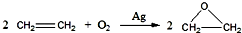
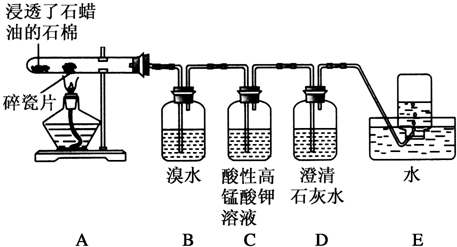
查看答案和解析>>
科目: 来源: 题型:实验题
| 浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
科目: 来源: 题型:解答题
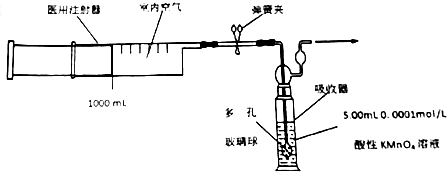
查看答案和解析>>
科目: 来源: 题型:推断题
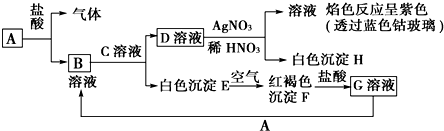
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 过氧化钠是淡黄色固体,久置于空气中变成白色的氢氧化钠固体 | |
| B. | 过氧化钠中阴阳离子比例为1:2 | |
| C. | 用过氧化钠漂白织物、麦秆等日久又逐渐变成黄色 | |
| D. | Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在点燃易燃气体前,必须检验气体的纯度 | |
| B. | 在稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒搅拌 | |
| C. | 浓酸对皮肤有腐蚀性,如不慎沾到皮肤上,应用较多的水冲洗,再涂上硼酸稀溶液 | |
| D. | 不得点燃添满酒精的酒精灯 |
查看答案和解析>>
科目: 来源: 题型:实验题
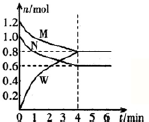
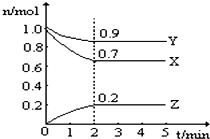 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com