
科目: 来源: 题型:选择题
| A. | 分子组成相差一个或几个“-CH2-”原子团的物质互为同系物,它们有相似的化学性质和不同的物理性质 | |
| B. | 甲烷是烷烃中碳的含量最低的,也是最简单的烃 | |
| C. | 不带支链的烃,其分子都是直线型的 | |
| D. | 常温时烷烃的同系物,只有四种呈气态 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X中肯定有碳碳双键 | |
| B. | X中可能有三个羟基和一个 一COOR官能团 | |
| C. | X中可能有三个羧基 | |
| D. | X中可能有两个羧基和一个羟基 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单氢化物的稳定性:R>B>C | |
| B. | R分别与A、B、C均组成共价化合物 | |
| C. | 单质的沸点:R>B>A>C | |
| D. | 最高价氧化物对应的水化物的酸性:C>B |
查看答案和解析>>
科目: 来源: 题型:解答题
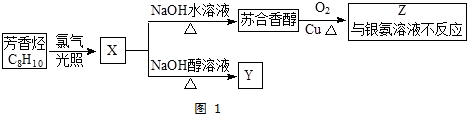
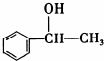 ,它不能发生的有机反应类型有④、⑥.
,它不能发生的有机反应类型有④、⑥.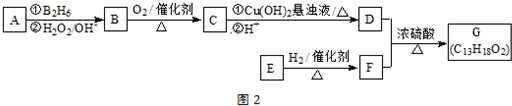
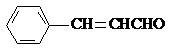 .
.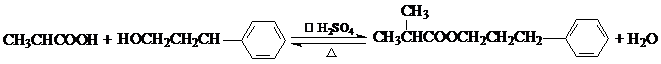 .
.查看答案和解析>>
科目: 来源: 题型:推断题
 有机物A是一种含溴的酯,分子式为C6H9O2Br.已知A有如下的转化关系:
有机物A是一种含溴的酯,分子式为C6H9O2Br.已知A有如下的转化关系:查看答案和解析>>
科目: 来源: 题型:解答题
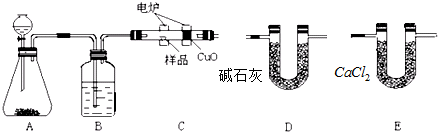
查看答案和解析>>
科目: 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目: 来源: 题型:推断题
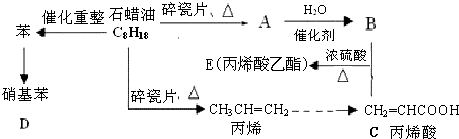
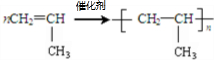 ;反应类型加聚反应.
;反应类型加聚反应.查看答案和解析>>
科目: 来源: 题型:推断题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com