
科目: 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{18}$O | |
| B. | Ga的原子结构简图 | |
| C. | 水分子的电子式: | |
| D. | 乙酸甲酯的结构简式:HCOOC2H5 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 77 | B. | 37 | C. | 191 | D. | 114 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后得到的上层清液,加入2滴K4[Fe(CN)6](亚铁氰化钾)溶液 | 若产生暗蓝色沉淀,则猜想一不成立. |
| 步骤二:取探究Ⅲ中所得溶液,加入少量乙醚,充分振荡,静置分层 | 若乙醚层呈红色,则猜想二成立. |
查看答案和解析>>
科目: 来源: 题型:实验题

| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
查看答案和解析>>
科目: 来源: 题型:实验题
 ;含有的化学键类型有离子键和共价键.
;含有的化学键类型有离子键和共价键.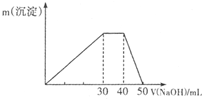
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2O2与H2O反应产生O2:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| B. | 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 向铜片中滴加浓硫酸并加热,有刺激性气味气体产生:Cu+4H++SO42- $\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| D. | 向明矾溶液中滴入少量氢氧化钡溶液:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com