
科目: 来源: 题型:实验题
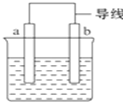 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:实验题
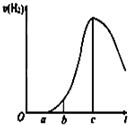 某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图.
某化学小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图.查看答案和解析>>
科目: 来源: 题型:推断题
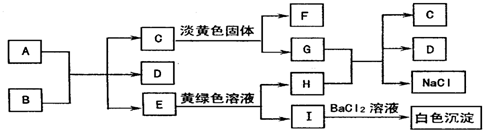
 .
.查看答案和解析>>
科目: 来源: 题型:推断题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
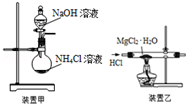
| A. | 焰色反应实验时,在蘸取待测液前,先用稀盐酸洗净铂丝并灼烧至无色 | |
| B. | 使用分液漏斗和容量瓶时,首先要查是否漏水 | |
| C. | 实验室用装置甲制取NH3 | |
| D. | 用装置乙制取无水MgCl2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 8% H2O2溶液:H+、Fe2+、SO42-、Cl- | |
| B. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| C. | 使甲基橙呈红色的溶液:Na+、NH4+、AlO2-、CO32- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、CO32-、ClO- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al2O3、Fe2O3均为两性氧化物 | |
| B. | 该反应中化学能全部转化为热能 | |
| C. | Al2O3中的微粒半径:r(Al3+)>r(O2-) | |
| D. | 在该反应条件下,Al的还原性强于Fe的还原性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可根据硫酸密度的大小判断铅蓄电池是否需要充电 | |
| B. | 当物质中的化学键发生断裂时,一定发生化学变化 | |
| C. | 淀粉和纤维素的化学式均为(C6H10O5)n,故互为同分异构体 | |
| D. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质一定是纯净物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com