
科目: 来源: 题型:选择题
| A. | 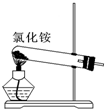 制取氨气 制取氨气 | |
| B. | 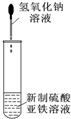 可用于制备氢氧化亚铁并观察其颜色 可用于制备氢氧化亚铁并观察其颜色 | |
| C. |  X若为四氯化碳,可用于吸收氨气,并防止倒吸 X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| D. | 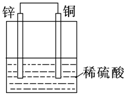 原电池,锌电极为负极,发生还原反应 原电池,锌电极为负极,发生还原反应 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:推断题
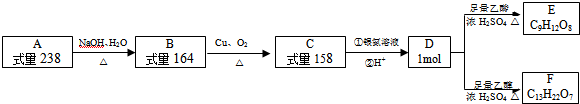
 ,A的结构简式
,A的结构简式 .
. .
.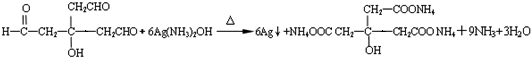 .
.查看答案和解析>>
科目: 来源: 题型:实验题
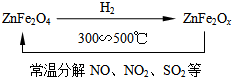 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该化合物既可以与Br2的CCl4溶液发生加成又可以与浓溴水发生取代反应 | |
| B. | 该化合物具有还原性,能被过氧化物氧化,还能与氯化铁溶液反应 | |
| C. | 具有苯环上与阿魏酸相同取代基,又与阿魏酸互为同分异构体的化合物应有8种 | |
| D. | 阿魏酸乙酯的分子式为C12H14O4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 沸点由高到低的排列顺序:HF>HI>HBr>HCl | |
| B. | PCl3和BF3分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | H2O是极性分子,分子中O原子不处在2个H原子所连直线的中央 | |
| D. | 离子晶体可含有极性共价键,也可含有非极性共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向100mL 0.1mol/L的FeSO4溶液中,加入0.01mol Na2O2固体2Fe2++2Na2O2+2H2O═4Na++2Fe(OH)2+O2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-═2C6H5OH+CO32- | |
| D. | 向40mL0.5mol/LFeBr2溶液中通入448mLCl2(标准状况):2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:填空题
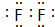 .
.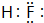 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.5mol•L-1•min-1 | B. | 2.5mol•L-1•min-1 | ||
| C. | 2mol•L-1•min-1 | D. | 5mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com