
科目: 来源: 题型:推断题
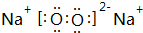 ,其中含有的化学键类型为离子键、共价键.
,其中含有的化学键类型为离子键、共价键.查看答案和解析>>
科目: 来源: 题型:实验题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目: 来源: 题型:选择题
 .下列关于该有机物的叙述不正确的是( )
.下列关于该有机物的叙述不正确的是( )| A. | 能与金属钠发生反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 在浓H2SO4催化下能与乙酸发生酯化反应 | |
| D. | 具有酸性,可以与氢氧化钠溶液反应 |
查看答案和解析>>
科目: 来源: 题型:实验题
 某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨).
某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定大于92.0 kJ | B. | 一定等于92.0 kJ | C. | 一定小于92.0 kJ | D. | 不能确定 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 非金属性X>Y>Z | |
| B. | X、Y、Z形成的阴离子还原性逐渐增强 | |
| C. | 原子半径X<Y<Z | |
| D. | X、Y、Z的气态氢化物稳定性由弱到强 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe位于元素周期表的第四周期ⅧB族 | |
| B. | ${\;}_{22}^{46}$TiO2、${\;}_{22}^{48}$TiO2、${\;}_{22}^{50}$TiO2互为同位素 | |
| C. | 工业上利用热还原法冶炼金属Fe | |
| D. | ${\;}_{41}^{92}Nb$3+原子核内有51个中子,核外有41个电子 |
查看答案和解析>>
科目: 来源: 题型:推断题
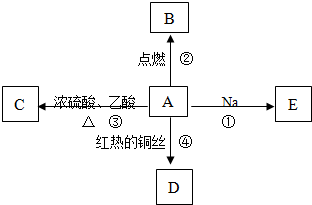
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com