
科目: 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | … |
| CH4O | C2H6O | C3H8O | x | C5H12O | C6H14O | … |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+的电子排布图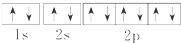 | B. | Na+的结构示意图: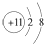 | ||
| C. | Na的电子排布式:1s22s22p63s1 | D. | Na的简化的电子排布式:[Na]3s1 |
查看答案和解析>>
科目: 来源: 题型:推断题
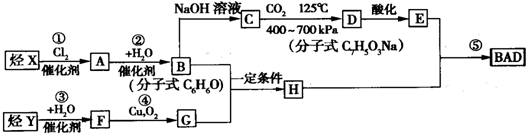

 .
. ;
;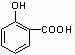 +
+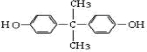 →
→ +2H2O.(不须写反应条件)
+2H2O.(不须写反应条件)查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HCl>NH3>HI | B. | HI>HCl>NH3 | C. | HCl>HI>NH3 | D. | NH3>HI>HCl |
查看答案和解析>>
科目: 来源: 题型:实验题
 三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.
三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到.查看答案和解析>>
科目: 来源: 题型:推断题
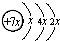 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | X、Z、Y、W的原子半径依次减小 | |
| B. | 若W与Y的原子序数相差5,则二者形成化合物的化学式可能为Y3W2 | |
| C. | W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| D. | W与X形成的化合物只含离子键 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 检验次数 | 溶液中检验出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NH4Cl |
| 第二次 | NH4Cl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、NH4Cl、K2CO3、NaCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | M与T形成的化合物具有两性 | D. | 氢化物的沸点为H2T<H2R |
查看答案和解析>>
科目: 来源: 题型:推断题
 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com