
科目: 来源: 题型:选择题
| A. | Na2O2既是氧化剂,又是还原剂 | |
| B. | O2是还原产物,Mn2+是氧化产物 | |
| C. | 通常用浓盐酸酸化高锰酸钾溶液 | |
| D. | 标准状况下,产生22.4 L O2时反应转移2 mol e- |
查看答案和解析>>
科目: 来源: 题型:填空题
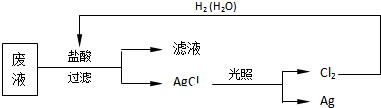
查看答案和解析>>
科目: 来源: 题型:选择题
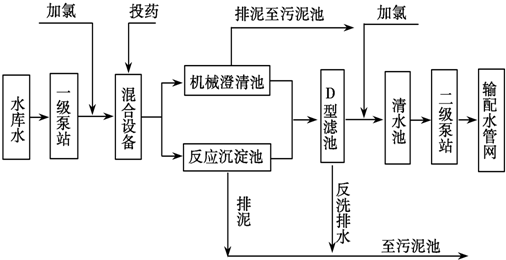
| A. | 若用FeSO4作混凝剂,最终铁将以Fe(OH)2形式进入反应沉淀池 | |
| B. | 投药时常加入适量的石灰,是为了除去水中Mg2+、HCO3-等 | |
| C. | 自来水生产中,前面加氯起消毒杀菌作用,后面加氯是保持水中有效氯的含量,防止自来水二次污染 | |
| D. | 用ClO2消毒自来水,消毒效率是等质量氯气的2.63倍 |
查看答案和解析>>
科目: 来源: 题型:选择题
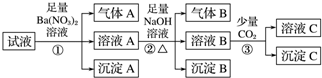
| A. | 原溶液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 原溶液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为2AlO-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑥ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目: 来源: 题型:填空题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
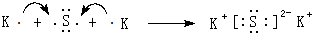 .
.查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铜为阳极、铜为阴极,电解液为CuSO4溶液 | |
| B. | 石墨为阳极、铁为阴极,电解液为CuSO4溶液 | |
| C. | 铁为阳极,铜为阴极,电解液为AgNO3溶液 | |
| D. | 石墨为阳极,铁为阴极,电解液为NaCl溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| B. | 一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱 | |
| C. | 水的离子积只与温度有关,向水中加入酸、碱或盐一定会影响水的电离平衡 | |
| D. | 硅是应用广泛的半导体材料,常温下只与氟气、氢氟酸反应,不和任何其它物质反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com