
科目: 来源: 题型:选择题
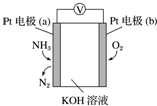 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极a移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | 负极的电极反应式为2NH3-6e-+6OH-═N2+6H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol-NH2中含有的电子数为0.7NA | |
| B. | 标准状况下,2.24 L乙醇中含有的C-H数目为0.5NA | |
| C. | 常温常压下,65 g Zn与足量浓H2SO4充分反应,转移电子数一定为2NA | |
| D. | 2.24 L NO与1.12 L O2充分反应所得气体中原子数目一定为0.3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
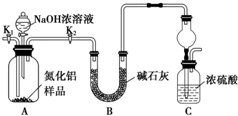
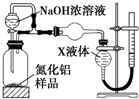
 d.NH4Cl溶液
d.NH4Cl溶液
查看答案和解析>>
科目: 来源: 题型:选择题
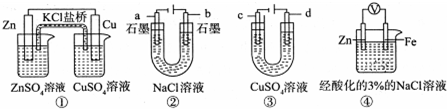
| A. | 装置①中,盐桥中的 K+移向CuSO4溶液 | |
| B. | 装置②在电解过程中,a极上得到22.4 L气体(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数) | |
| C. | 可以用装置③在铜上镀银,c极为银 | |
| D. | 装置④中一段时间后会有Fe(OH)2生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 目前使用的燃料液化石油气,其主要成分均属于烯烃 | |
| B. | 食用白糖的主要成分是蔗糖,小苏打的主要成分是碳酸钠 | |
| C. | 用碱式滴定管量取20.00mL0.1mol/LKMnO4溶液 | |
| D. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ”和画“×”分别标明B和N的相对位置.
”和画“×”分别标明B和N的相对位置.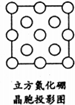
查看答案和解析>>
科目: 来源: 题型:解答题
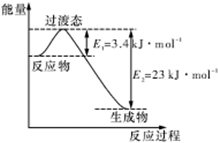 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目: 来源: 题型:实验题
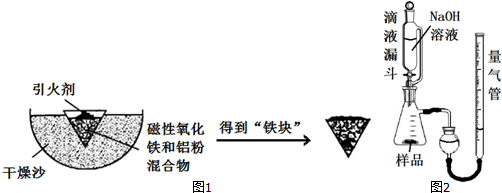

| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
查看答案和解析>>
科目: 来源: 题型:选择题
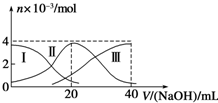
| A. | 等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水大 | |
| B. | 当V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| C. | NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A) | |
| D. | 向上述加入20mLNaOH溶液后所得溶液中再加入水的过程中,pH可能减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com