
科目: 来源: 题型:推断题
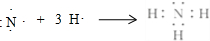 ;
;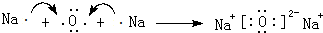 .
.查看答案和解析>>
科目: 来源: 题型:填空题
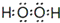 ;
;查看答案和解析>>
科目: 来源: 题型:解答题

 .该阳离子中存在的化学键有共价键.
.该阳离子中存在的化学键有共价键. .
.查看答案和解析>>
科目: 来源: 题型:解答题
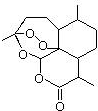
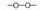 ,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)
,需要在有机合成中引入羟基,引入羟基的反应类型有①②⑤.(选填编号)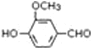 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图: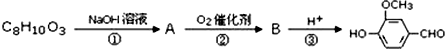
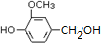 .
.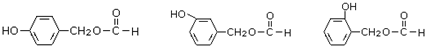 .
.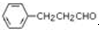 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用).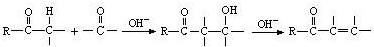
查看答案和解析>>
科目: 来源: 题型:解答题
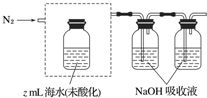
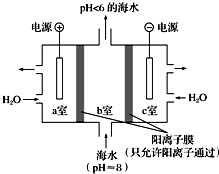
查看答案和解析>>
科目: 来源: 题型:实验题
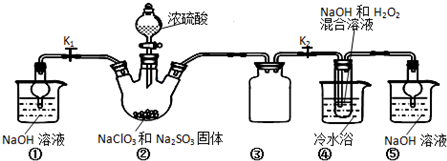
查看答案和解析>>
科目: 来源: 题型:选择题
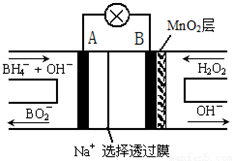
| A. | 放电过程中,正极附近溶液中的H+浓度减小 | |
| B. | 电池正极区的电极反应为:BH${\;}_{4}^{-}$+8OH--8e-=BO$_2^-$+6H2O | |
| C. | 放电过程中,Na+从正极区向负极区迁移 | |
| D. | 在电池反应中,每消耗1L 6 mol/LH2O2溶液,理论上流过电路中的电子为6NA个 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| B. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,转移2NA个电子 | |
| C. | 标准状况下,2.24L辛烷中所含极性共价键的数目为1.8 NA | |
| D. | 电镀铜时,若阴极得到电子数为2NA个,则阳极质量减少64g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| C. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| D. | 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向0.1 mol•L-1的CH3COOH溶液中加入少量碳酸钙固体,溶液的pH增大 | |
| B. | 室温下,pH=4的NaHSO4溶液中,水电离出的H+浓度为1×10-10 mol•L-1 | |
| C. | 浓度均为0.1 mol•L-1的HCN溶液和NaCN溶液等体积混合(忽略体积变化),溶液中c(HCN)+c(CN-)=0.1 mol•L-1 | |
| D. | pH相同的①NH4Cl、②NH4Al(SO4)2、③(NH4)2SO4三种溶液的c(NH${\;}_{4}^{+}$):②<③<① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com