
科目: 来源: 题型:实验题
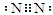 .
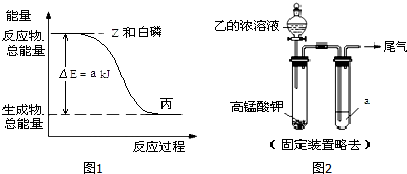
.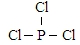 .白磷固体和 Z 气体反应,生成 1mol 液态丙时,能量变化如图1所示,写出该反应的热化学方程式:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol.已知 1mol 白磷固体和 Z 气体反应,生成固态丁时,放热 bkJ,则 1mol 固态丁转化为液态丙时的反应热△H=(a-$\frac{b}{4}$ )kJ/mol.
.白磷固体和 Z 气体反应,生成 1mol 液态丙时,能量变化如图1所示,写出该反应的热化学方程式:$\frac{1}{4}$P4(s)+$\frac{3}{2}$Cl2(g)=PCl3(l)△H=-a kJ/mol.已知 1mol 白磷固体和 Z 气体反应,生成固态丁时,放热 bkJ,则 1mol 固态丁转化为液态丙时的反应热△H=(a-$\frac{b}{4}$ )kJ/mol.查看答案和解析>>
科目: 来源: 题型:解答题

 .
.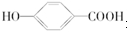 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) .
.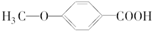 的同分异构体很多,其中符合下列条件的有3种.
的同分异构体很多,其中符合下列条件的有3种. .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
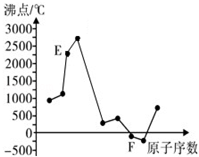 A、B、C、D、E、F是元素周期表中前20号元素,它们的原子序数依次增大.A、B可分别与C组成常见化合物AC、AC2、BC、BC2;D元素的焰色反应呈黄色;E、F两元素单质的沸点与元素原子序数的关系如图(图中原子序数连续).
A、B、C、D、E、F是元素周期表中前20号元素,它们的原子序数依次增大.A、B可分别与C组成常见化合物AC、AC2、BC、BC2;D元素的焰色反应呈黄色;E、F两元素单质的沸点与元素原子序数的关系如图(图中原子序数连续).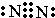 ,化合物AC2的结构式O=C=O;C、D、F对应的简单离子半径由小到大的顺序为Na+<O2-<Cl-(用离子符号表示).
,化合物AC2的结构式O=C=O;C、D、F对应的简单离子半径由小到大的顺序为Na+<O2-<Cl-(用离子符号表示).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(H+)=10-4mol•L-1的溶液中:NH4+、K+、SO42-、NO3- | |
| B. | 无色溶液中:Na+、Cu2+、Cl-、NO3- | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、I- | |
| D. | 饱和氯水中:Cl-、Na+、NO3-、SO32- |
查看答案和解析>>
科目: 来源: 题型:解答题


 ,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种.
,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有6种. .
.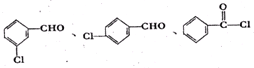 (不考虑立体异构).
(不考虑立体异构).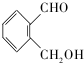 为有机原料制备化合物
为有机原料制备化合物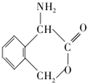 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).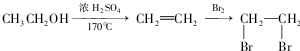 )
)查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=7的NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-) | |
| B. | 0.1mol•L-1的KHA溶液,其PH=10:c(K+)>c(OH-)>c(HA-)>c(H+) | |
| C. | 20mL0.1mol•L-1醋酸钠溶液与10mL 0.1mol•L-1盐酸混合后的溶液中: 2 c(H+)+c(CH3COOH)=c(CH3COO-)+2 c(OH-) | |
| D. | 在25mL 0.1 mol•L-1NaOH溶液中逐滴加入0.2mol•L-1CH3COOH溶液,溶液pH变化如图所示,在A、B间任一点,溶液中一定都存在下列关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)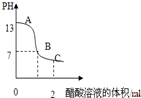 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 工业上常用电解法制备元素C、D、E的单质 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | 化合物AE与CE具有相同类型的化学键 | |
| D. | 元素A、B组成的化合物常温下一定呈气态 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molCH3+(甲基碳正离子)含有的电子数目为9NA | |
| B. | 27g Al在标准状况下的22.4L Cl2中燃烧,转移的电子总数为3 NA | |
| C. | 0.2 mol•L-1的Na2CO3溶液中含有CO32-的数目一定小于0.2NA | |
| D. | 7.8gNa2S和Na2O2的混合物中含有的阴离子总数为0.1 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| B. | 喝补铁剂时,加服维生素C,效果更好,原因是维生素C具有氧化性 | |
| C. | 食用花生油和鸡蛋清都能发生水解反应 | |
| D. | “地沟油”经加工处理后,可用于生产肥皂和生物柴油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com