
科目: 来源: 题型:选择题
| A. | Z与X的最高价氧化物对应水化物反应可产生W的单质气体 | |
| B. | X、Y、Z三种元素的最高价氧化物对应水化物两两可发生反应 | |
| C. | Y的氧化物都可做呼吸面具的供氧剂 | |
| D. | W与X之间只能形成极性共价化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 |
查看答案和解析>>
科目: 来源: 题型:实验题
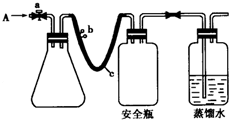 实验室用如图方法测定某水样中O2的含量.
实验室用如图方法测定某水样中O2的含量.查看答案和解析>>
科目: 来源: 题型:实验题
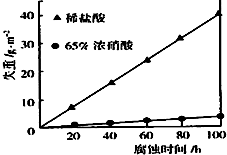 按要求回答下列问题:
按要求回答下列问题:查看答案和解析>>
科目: 来源: 题型:实验题
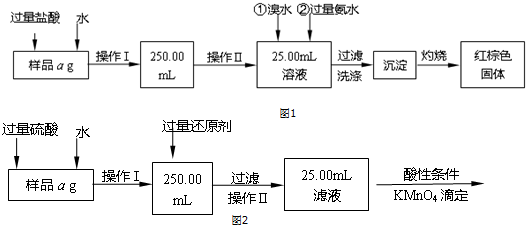
查看答案和解析>>
科目: 来源: 题型:推断题
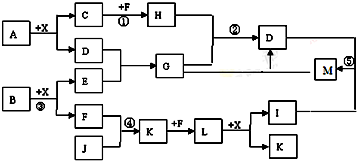
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:4 | D. | 4:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②④⑥⑦ | B. | ③⑤⑥⑦ | C. | ④⑤⑥ | D. | ①②③ |
查看答案和解析>>
科目: 来源: 题型:选择题
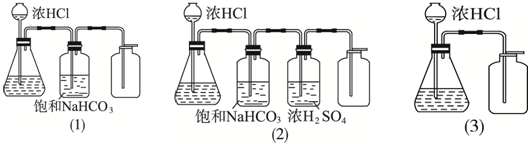
| A. | (1)(2)(3)一样重 | B. | (1)中最重 | C. | (2)中最重 | D. | (3)最轻 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蒸发结晶操作时,当有大量晶体析出时停止加热,用余热蒸干 | |
| B. | 蒸馏操作时,应使温度计水银球插入液态混合物中 | |
| C. | 分液操作时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 | |
| D. | 萃取操作时,萃取剂要和原溶剂互不相溶,且不能与溶质和溶剂反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com