
科目: 来源: 题型:选择题
 自然界中金属硫化物之间存在原电池反应,下图所示装置中电极I为方铅矿(PbS),电极Ⅱ为含有方铅矿的硫铁矿,当有电解质溶液按如图所示方向流经该装置时,电流表指针偏转.若电极Ⅱ质量不断减少,a处溶液中加入KSCN溶液未出现红色,加入CuSO4溶液未出现黑色沉淀.下列有关说法中正确的是( )
自然界中金属硫化物之间存在原电池反应,下图所示装置中电极I为方铅矿(PbS),电极Ⅱ为含有方铅矿的硫铁矿,当有电解质溶液按如图所示方向流经该装置时,电流表指针偏转.若电极Ⅱ质量不断减少,a处溶液中加入KSCN溶液未出现红色,加入CuSO4溶液未出现黑色沉淀.下列有关说法中正确的是( )| A. | 工业上利用该原理富集铁 | |
| B. | 电极Ⅱ作正极 | |
| C. | 溶液流经该装置后pH增大 | |
| D. | 该装置负极的电极反应为FeS2-15e-+8H2O=Fe3++2SO42-+16H+ |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
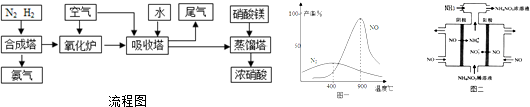
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 常温常压下,11.2L氧气中所含有的原子数为NA | |
| B. | 17g的NH3分子中含有的电子数为10NA | |
| C. | 常温常压下,48g O3含有的氧原子数为3NA | |
| D. | 标准状况下,11.2LH2O中所含有的分子数为0.5NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 浓HNO3的氧化性比稀HNO3,故有时在实验室看到的浓硝酸呈黄色 | |
| B. | Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg | |
| C. | Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 | |
| D. | AlCl3易水解,故由AlCl3•6H2O制无水AlCl3应在HCl气流中加热 |
查看答案和解析>>
科目: 来源: 题型:实验题
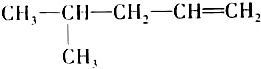
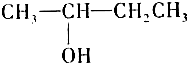
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com