
科目: 来源: 题型:填空题
 ,写出B与浓硝酸反应的化学方程式
,写出B与浓硝酸反应的化学方程式 ,写出B与液溴反应的方程式
,写出B与液溴反应的方程式 .
.查看答案和解析>>
科目: 来源: 题型:解答题
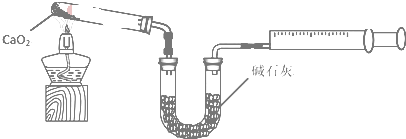
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
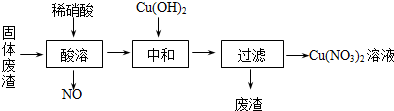
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
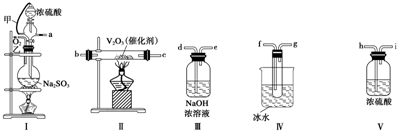
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通入氧气的一极为正极,发生氧化反应 | |
| B. | 该电池负极的电极反应为2H2-4e-=4H+ | |
| C. | 该电池工作一段时间,电解质溶液浓度保持不变 | |
| D. | 该电池在工作时,溶液中的阴离子向负极移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径由大到小:Z>Y>X>W | B. | 阴离子的还原性:Y>Z | ||
| C. | 氢化物的沸点:Y>X | D. | 氧化物对应水化物的酸性:Y<Z |
查看答案和解析>>
科目: 来源: 题型:选择题
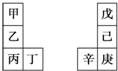 甲~辛等元素在周期表中的相对位置如右表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如右表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 最高价氧化物水化物酸性:戊<己 | |
| C. | 丙与庚的原子核外电子数相差13 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com