
科目: 来源: 题型:填空题
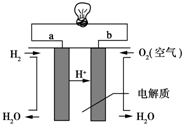 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目: 来源: 题型:填空题
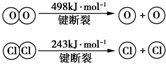 用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:4HCl+O2$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$Cl2+H2O,已知:反应A中,4mol HCl被氧化,放出115.6kJ的热量.
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:4HCl+O2$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$Cl2+H2O,已知:反应A中,4mol HCl被氧化,放出115.6kJ的热量.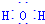 .
.查看答案和解析>>
科目: 来源: 题型:实验题
 Ⅰ.控制变量法是化学实验的一种常用方法.如表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.如表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 100 mL 2 mol/L盐酸与锌反应时,加入100 mL氯化钠溶液,生成氢气的速率不变 | |
| B. | 对于可逆反应2CO+2NO?N2+2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快 | |
| C. | 二氧化硫的催化氧化是一个放热反应,升高温度,正反应速率减慢 | |
| D. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快氢气的产生 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某些花岗石产生氡($\stackrel{222}{86}$Rn),从而对人体产生伤害,$\stackrel{222}{86}$Rn的质量数是222 | |
| B. | Se是人体必需的微量元素,$\stackrel{78}{34}$Se和$\stackrel{80}{34}$Se互为同位素 | |
| C. | $\stackrel{13}{6}$C-NMR(核磁共振)可用于含碳化合物的结构分析,$\stackrel{13}{6}$C的中子数为6 | |
| D. | 原子结构示意图 既可以表示16O,也可以表示18O 既可以表示16O,也可以表示18O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 全部 | B. | ②③④ | C. | ①②④ | D. | ②③④⑤ |
查看答案和解析>>
科目: 来源: 题型:实验题
温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-38 |
查看答案和解析>>
科目: 来源: 题型:实验题
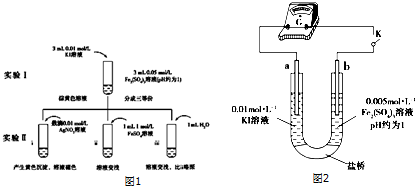
查看答案和解析>>
科目: 来源: 题型:推断题
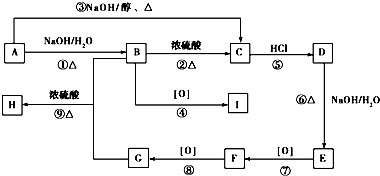
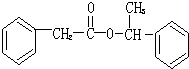 .
. .
. ,用化学方程式表示检验 F 中官能团的常用方法
,用化学方程式表示检验 F 中官能团的常用方法 .
.查看答案和解析>>
科目: 来源: 题型:填空题
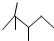 ,有机物 B 与等物质的量的 H2发生加成反应可得到有机物 A.则:
,有机物 B 与等物质的量的 H2发生加成反应可得到有机物 A.则:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com