
科目: 来源: 题型:选择题
| A. | 0.5Q | B. | Q | C. | 2Q | D. | 5Q |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该元素的电负性是同主族最大的 | |
| B. | 其轨道表示式为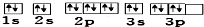 | |
| C. | 该元素的第一电离能是同周期元素中最大的 | |
| D. | 该元素可以形成2种常见的氧化物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解后溶液中c(H+)为2 mol•L-1 | B. | 上述电解过程中转移电子总数为NA | ||
| C. | 电解得到的Cu的物质的量为1 mol | D. | 原混合溶液中 c(K+)为5 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.5mol C | B. | 1mol B、3mol C | ||
| C. | 1.5mol B和1.5mol C | D. | 2mol A、2mol B和3mol C |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | NaCl (NaCl ) | B. | MgSO4(MgO) | C. | CuSO4(CuO) | D. | CuCl2(CuCl2) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙基(-CH2CH3) | B. | 碳正离子[(CH3)3C+] | C. | 乙炔 (C2H2) | D. | 羧基 (-COOH) |
查看答案和解析>>
科目: 来源: 题型:推断题
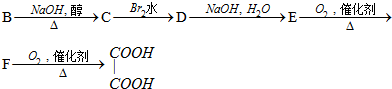

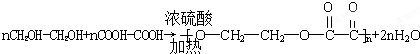 .
.查看答案和解析>>
科目: 来源: 题型:实验题
| 实验步骤 | 实验结论 氧化性从强到弱的顺序:氯、溴、碘 |
| ①氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ②NaBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
查看答案和解析>>
科目: 来源: 题型:实验题

| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1 KSCN溶液,静置 | 出现白色沉淀 |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1 AgNO3溶液 | 现象a出现白色沉淀,溶液红色变浅 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1 KI溶液 | 出现黄色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com