
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
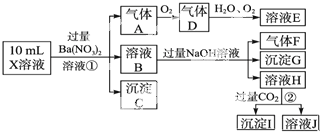
查看答案和解析>>
科目: 来源: 题型:解答题
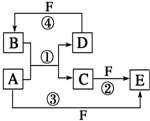 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)查看答案和解析>>
科目: 来源: 题型:解答题

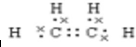 ,A分子内含有的官能团是(填名称)醛基.
,A分子内含有的官能团是(填名称)醛基.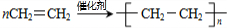 .
.查看答案和解析>>
科目: 来源: 题型:解答题
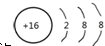 ,A2C2的结构式:H-O-O-H.
,A2C2的结构式:H-O-O-H.查看答案和解析>>
科目: 来源: 题型:解答题
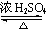 CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式为
CH3COOCH2CH=CH2+H218O,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式为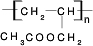 .
.查看答案和解析>>
科目: 来源: 题型:解答题
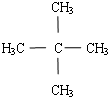 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:A<B<C<D | |
| B. | 最高价氧化物对应水化物的酸性:D<C | |
| C. | 非金属性:A>C | |
| D. | 单质B常温下能溶于浓硝酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+ 1s22s22p6 | B. | F?1s22s22p6 | C. | N3+ 1s22s22p6 | D. | O2?1s22s22p6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com