
科目: 来源: 题型:选择题
| A. | 只有①②④⑤ | B. | 全部 | C. | 只有①② | D. | 只有①②③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 水 | B. | 脂肪类物质 | C. | 淀粉类物质 | D. | 蛋白质 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
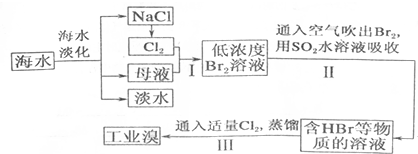
查看答案和解析>>
科目: 来源: 题型:解答题
 ,F
,F ,AB2
,AB2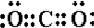 ,A的最简单气态氢化物
,A的最简单气态氢化物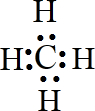 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放热反应在常温下一定都能发生 | |
| B. | 等质量的石墨与金刚石完全燃烧,金刚石放出的热量多 | |
| C. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| D. | 石墨比金刚石稳定 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 电池放电时Cl-由正极向负极迁移 | |
| C. | 正极反应式为Ag++e-=Ag | |
| D. | 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ②④⑤ | D. | ①③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | G+H=W,其它条件相同时,分别在200℃和100℃下进行反应 | |
| B. | 相同温度下,颗粒相同的锌粒分别与H+浓度相同的硫酸和盐酸反应 | |
| C. | A+B=C(500℃下进行) D+E=F(100℃下进行) | |
| D. | 相同温度下,锌粒与铁粉分别与同浓度的盐酸反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Q1=Q2=Q3 | B. | Q3<Q1<Q2 | C. | Q3<Q2<Q1 | D. | Q1<Q2<2Q3 |
查看答案和解析>>
科目: 来源: 题型:选择题
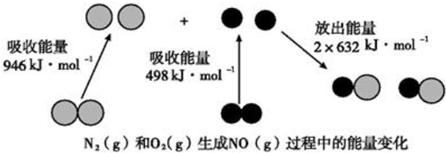
| A. | 1mol N2(g)和1mol O2(g)反应放出的能量为180kJ | |
| B. | 1mol N2(g)和1mol O2(g)具有的总能量小于2molNO(g)具有的总能量 | |
| C. | 该反应中反应物断开化学键所吸收的总能量小于生成物形成化学键所释放出的总能量 | |
| D. | 恒容密闭容器中,充入Ar气,该反应速率加快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com