
科目: 来源: 题型:选择题
 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)$\frac{\underline{\;电解\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔)$\frac{\underline{\;电解\;}}{\;}$4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠:3Fe+4NaOH$\frac{\underline{\;1100℃\;}}{\;}$Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生电解反应2OH--2e-═H2↑+O2↑ | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数不同 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如上图),电解槽中石墨极为阴极,铁为阳极 |
查看答案和解析>>
科目: 来源: 题型:解答题
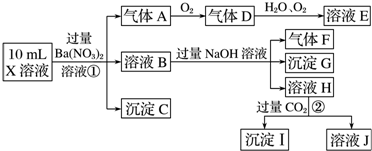
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ($\frac{b}{10}$-$\frac{a}{20}$) mol•L-1 | B. | (2b-a) mol•L-1 | C. | (5b-$\frac{5a}{2}$) mol•L-1 | D. | (10b-5a) mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3.4g NH3中含有的电子数为0.2NA | |
| B. | 标准状况下,22.4L Cl2参加所有化学反应转移的电子数一定都是2NA | |
| C. | 标准状况下,0.5NA个HF分子所占的体积约为11.2L | |
| D. | 500mL 1mol/L氯化铁溶液中的Fe3+数小于0.5NA |
查看答案和解析>>
科目: 来源: 题型:实验题
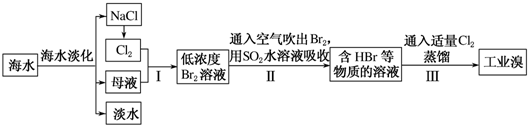
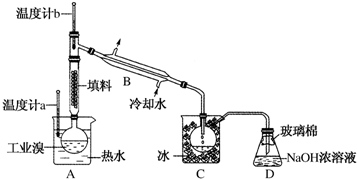
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放电过程中KOH的物质的量浓度不变 | |
| B. | 负极反应为14H2O+7O2+28e-=28OH- | |
| C. | 放电一段时间后,负极周围的pH升高 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 合成甲醇:CO+2H2$→_{加热加压}^{催化剂}$CH3OH | |
| B. | 合成乙醛:2CH2=CH2+O2$→_{加热加压}^{催化剂}$2CH3CHO | |
| C. | 合成有机玻璃单体-甲基丙烯酸甲酯: 第1步: 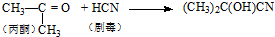 第2步: 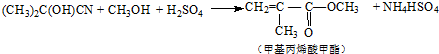 | |
| D. | 合成全降解聚碳酸酯塑料: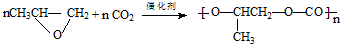 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 海水蒸发制海盐的过程中只发生了物理变化 | |
| B. | 加入明矾,使海水的盐分沉淀并淡化 | |
| C. | 海水淡化的方法主要有蒸馏法、离子交换法和电渗析法等 | |
| D. | 大海中含有钾、溴、碘等元素,需经过氧化还原反应才可得到钾、溴、碘的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com