
科目: 来源: 题型:选择题
| A. | 18gC含有9NA个电子 | |
| B. | 标准状况下22.4LCCl4含有4NA个氯原子 | |
| C. | 标准状况下,33.6LN2和H2的混合气体中含3NA个原子 | |
| D. | 2.709×1024个原子的水分子含有1.5NA个氧原子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.3molNO2、0.1molNO | B. | 0.6molNO | ||
| C. | 0.3molNO、0.1molNO2 | D. | 0.2molNO2、0.2molNO |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 开始正反应速率最大 | |
| B. | V正(SO2):V正(O2)=2:1时,反应达到平衡状态 | |
| C. | 达到平衡V逆(SO3)最大 | |
| D. | 开始时V逆(SO3)=0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1体积NO | B. | 1体积NO2和$\frac{1}{2}$体积O2 | ||
| C. | $\frac{1}{4}$体积O2 | D. | $\frac{1}{3}$体积NO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol的羟基与1mol的氢氧根离子所含电子数均为9NA | |
| B. | 500mL0.1mol/L盐酸中,含有HCl分子数目为0.05NA | |
| C. | 1molNa被氧化生成NaNO3水溶液或NaCl,都失去NA个电子 | |
| D. | 1.0L1.0mol•L-1的NaNO3水溶液中含有的氧原子数为3NA |
查看答案和解析>>
科目: 来源: 题型:实验题
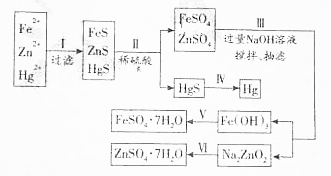
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ③④⑤⑦ | B. | ①③④⑦ | C. | ②③④⑤⑦ | D. | ②④⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com