
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题
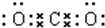 ;②NaOH
;②NaOH .
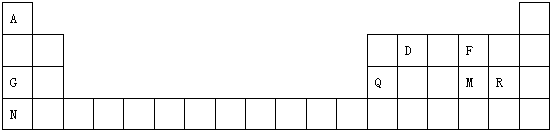
.| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目: 来源: 题型:推断题
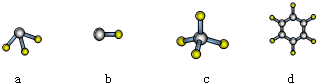
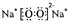 ,该物质含有的化学键的类型是离子键、非极性共价键 .
,该物质含有的化学键的类型是离子键、非极性共价键 .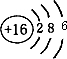 .
.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 所有含氢元素的化合物中都存在氢键,氢键比范德华力强 | |
| B. | H2O是一种非常稳定的化合物,就是由于水分子间形成氢键所致 | |
| C. | 氢原子和非金属性很强的元素原子(F、O、N)形成的共价键,称为氢键 | |
| D. | 分子间形成的氢键使相应物质的熔点和沸点升高,氢键也可存在于分子内 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 16O2与18O2互为同分异构体 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 16O与18O的质量数相同 | |
| D. | 标准状况下,1.12 L 16O2和1.12 L 18O2均含0.1 NA 个氧原子 |
查看答案和解析>>
科目: 来源: 题型:选择题
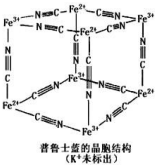 普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )
普鲁士蓝晶体结构如图所示(每两个立方体中,一个 K+在其中一个立方体中心,另一个则无 K+),下列说法正确的是( )| A. | 化学式可以表示为 KFe2(CN)6 | |
| B. | 每一个立方体中平均含有 24 个π键 | |
| C. | 普鲁士蓝不属于配位化合物 | |
| D. | 每个 Fe3+周围与之相邻的 Fe2+离子有 12 个 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com