
科目: 来源: 题型:解答题
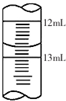 酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):Ag++Cl-=AgCl (白色)Ksp(AgCl)=1.8×l0-10
酱油是一种常用调味剂,根据国标要求酱油中NaCl的含量不应低于15g/100mL.莫尔法是较简单的一种测量Cl-含量的方法.现采用该法测量某市售酱油是否符合NaCl含量标准要求.实验原理如下(25℃):Ag++Cl-=AgCl (白色)Ksp(AgCl)=1.8×l0-10查看答案和解析>>
科目: 来源: 题型:选择题
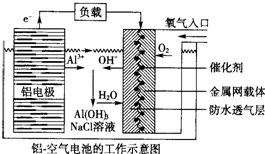
| A. | NaCl的作用是增强溶液的导电性 | |
| B. | 正极的电极反应式为O2+4e-+2H2O=4OH- | |
| C. | 电池工作过程中,电解质溶液的pH不断增大 | |
| D. | 用该电池作电源电解KI溶液制取1 mol KIO3,消耗铝电极的质量为54 g |
查看答案和解析>>
科目: 来源: 题型:解答题
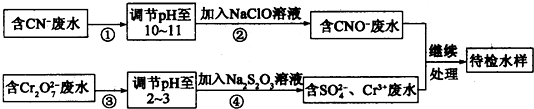
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验步骤与实验现象 | 实验结论 |
| Ⅰ.观察溶液:无色透明 | ①原溶液中一定不含的离子是Cu2+、MnO4-、Fe2+ |
| Ⅱ.取适量该溶液,加入过量的硝酸,有气体生成,并得到无色溶液 | ②原溶液中一定不含的离子是Mg2+、Ag+、Ba2+、Al3+、I-、SiO32-,一定含有的离子是CO32-、K+ |
| Ⅲ.在Ⅱ所得溶液中再加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀A | ③原溶液中还一定含有的离子是AlO2-,生成沉淀A的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
| Ⅳ.在Ⅲ所得溶液中再逐滴加入氢氧化钡溶液至过量,加热也有气体生成,同时析出白色沉淀B | ④白色沉淀B中一定含有BaCO3,可能含有BaSO4 |
 (3)该化学兴趣小组的同学为了进一步确定B的成分,取一定量经洗涤后的B与Y溶液反应,白色固体的物质的量与Y溶液体积之间的关系如图所示.
(3)该化学兴趣小组的同学为了进一步确定B的成分,取一定量经洗涤后的B与Y溶液反应,白色固体的物质的量与Y溶液体积之间的关系如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
 .该物质合成线路如图示:
.该物质合成线路如图示: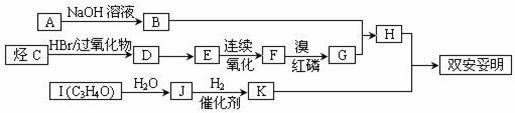
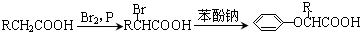
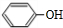 ,CC(CH3)2=CH2,ICH2=CH-CHO,JHOCH2CH2CHO.
,CC(CH3)2=CH2,ICH2=CH-CHO,JHOCH2CH2CHO.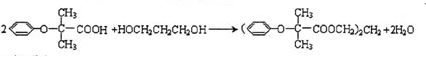 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4.6 g乙醇中含有的C-H键的个数为0.6NA | |
| B. | 34 gH2O2中含有的阴离子数为NA | |
| C. | 标准状况下,11.2 LCHCl3中含有的分子数为0.5NA | |
| D. | 9.2gNO2和N2O4混合气体中含有的原子总数为0.6NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 二氯丙烷(C3H6Cl2)的同分异构体共有3种 | |
| B. | 蛋白质溶液具有丁达尔效应,说明该蛋白质分子直径约1nm~100nm | |
| C. | 光导纤维被广泛应用,制造它的主要原料是二氧化硅 | |
| D. | 福尔马林溶液可以使蛋白质变性,所以农业上可以用福尔马林溶液浸制生物标本 |
查看答案和解析>>
科目: 来源: 题型:解答题

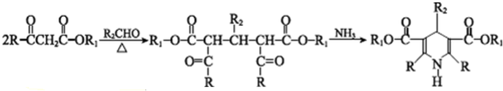
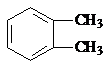 $→_{光}^{氯气}$
$→_{光}^{氯气}$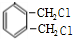 $→_{△}^{氢氧化钠溶液}$
$→_{△}^{氢氧化钠溶液}$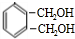 $→_{催化剂}^{氧气}$
$→_{催化剂}^{氧气}$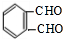 .
.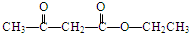 .
.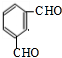 .
.查看答案和解析>>
科目: 来源: 题型:解答题
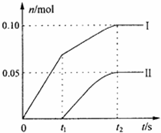
查看答案和解析>>
科目: 来源: 题型:解答题
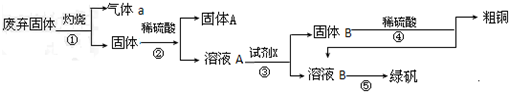
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com