
科目: 来源: 题型:选择题
| A. | ②③⑤⑥⑦ | B. | ③④⑤⑥⑦ | C. | ①②③⑤⑦⑥ | D. | ①③⑤⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定含有SO42- | B. | 一定含有Ag+ | ||
| C. | 可能含有SO42-或Ag+ | D. | 可能含有SO42-或Ag+或CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在烧瓶中装约$\frac{1}{3}$体积的自来水,并放入几粒沸石防暴沸 | |
| B. | 若使用温度计须将温度计水银球插到自来水中 | |
| C. | 冷水从冷凝管下口入,上口出 | |
| D. | 收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al3+、Ba2+、Cl-、NO3- | B. | K+、OH-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题

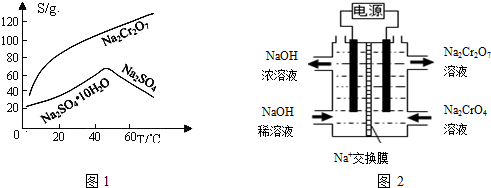
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用分液的方法分离汽油和煤油 | |
| C. | 用溶解、过滤的方法分离KNO3和NaCl固体混合物 | |
| D. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com