
科目: 来源: 题型:选择题
| A. | 凡需加热的反应一定是吸热反应 | |
| B. | 反应物的总能量比生成物的总能量大 | |
| C. | 氢氧化钠与盐酸的反应属于吸热反应 | |
| D. | CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
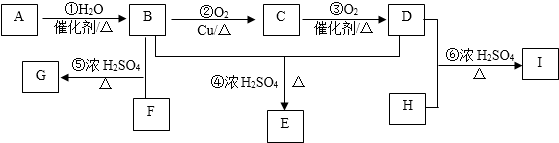
 .
.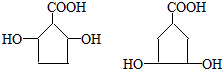 .
.查看答案和解析>>
科目: 来源: 题型:实验题
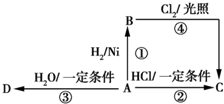 某烃A是有机化学工业的基础原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.
某烃A是有机化学工业的基础原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 1.5g甲基(-CH3)所含有的电子数是NA | |
| B. | 14g乙烯和丙烯的混合物中含有原子的数目为NA | |
| C. | 常温常压下,1molCnH2n+2中所含有的共价键数目为(3n+1)NA | |
| D. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4NA |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题
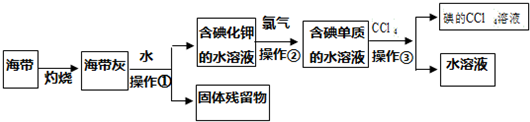
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
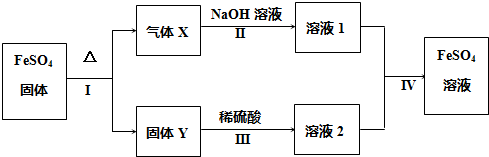
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com