
科目: 来源: 题型:选择题
| A. | H++OH-═H2O | B. | H++NH4++2OH-═NH3↑+2H2O | ||
| C. | 4H++NH4++5OH-═NH3↑+5H2O | D. | H++2NH4++3OH-═2NH3↑+3H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
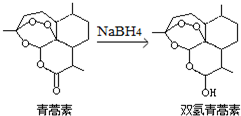 我国科学家屠呦呦获得2015年诺贝尔生理学或医学奖.她研究的青蒿素、双氢青蒿素在寄生虫疾病治疗方面取得了伟大成就.下列有关说法正确的是( )
我国科学家屠呦呦获得2015年诺贝尔生理学或医学奖.她研究的青蒿素、双氢青蒿素在寄生虫疾病治疗方面取得了伟大成就.下列有关说法正确的是( )| A. | 青蒿素易溶于水 | |
| B. | 青蒿素可与NaOH溶液反应 | |
| C. | 青蒿素转化为双氢青蒿素是氧化反应 | |
| D. | 青蒿素有11种一氯代物 |
查看答案和解析>>
科目: 来源: 题型:推断题
| A元素原子的核外p电子总数比s电子总数少1 |
| B原子核外所有p轨道全满或半满 |
| C元素的主族序数与周期数的差为4 |
| D是前四周期中电负性最小的元素 |
| E在周期表的第十一列 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用水鉴别乙醇、甲苯和溴苯 | |
| B. | 用燃烧法鉴别乙醇、苯 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
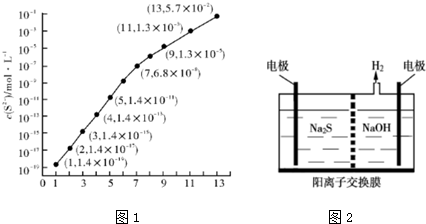
| Ka | Ka2 | |
| H2S03 | 1.3×10-2 | 6.3×10-8 |
| H2C03 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p 电子数 |
| X | 元素的原子半径是第三周期主族元素中最大的 |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
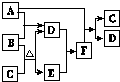 有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系: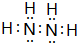 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com