
科目: 来源: 题型:实验题

| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水 | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 步骤 | 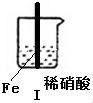 |  | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2═2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 | |
| D. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 |
查看答案和解析>>
科目: 来源: 题型:推断题
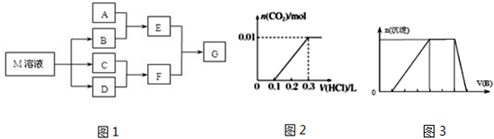
查看答案和解析>>
科目: 来源: 题型:推断题
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向NaHSO3溶液中加入NaHSO4溶液:HSO3-+H+═H2O+SO2↑ | |
| B. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:Al3++2Ba2++4OH-+2SO42-═2BaSO4↓+AlO2-+2H2O | |
| C. | 小苏打溶液与乙酸溶液混合 HCO3-+CH3COOH═CH3COO-+H2O+CO2↑ | |
| D. | AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向某溶液中滴加氯水,再滴加KSCN溶液,若溶液变成血红色,则原溶液中一定有Fe2+ | |
| B. | 钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,进行灼烧,直接观察火焰颜色 | |
| C. | 向某溶液中滴加氯化钡溶液,产生白色沉淀,再滴加足量稀硝酸,依然有白色固体,说明原溶液含有SO42- | |
| D. | 向某黄色溶液中加入淀粉溶液,若溶液变蓝色,则原溶液中含有I2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1L 0.1mol•L-1FeCl3溶液中含有的Fe3+离子数目为0.1NA | |
| B. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA | |
| D. | 常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ③④⑥ | B. | ②③⑤ | C. | ①②④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等物质的量的CaCl2和CaO2含有的离子数 | |
| B. | 等质量的水与重水含有的电子数 | |
| C. | 同温、同压同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com