
科目: 来源: 题型:选择题
| A. | 等物质的量的固体与足量的盐酸反应放出CO2的质量:Na2CO3>NaHCO3 | |
| B. | 相同条件下,溶于水溶液的碱性:Na2CO3<NaHCO3 | |
| C. | 常温下,在水中的溶解度:Na2CO3>NaHCO3 | |
| D. | 相同条件下,与稀盐酸反应的快慢:Na2CO3>NaHCO3 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
| 编号 | V (Na2CO3)/mL | 沉淀情况 | 编号 | 反应温度/℃ | 沉淀情况 | |
| 1 | 2.8 | 多、蓝色 | 1 | 40 | 多、蓝色 | |
| 2 | 2.4 | 多、蓝色 | 2 | 60 | 少、浅绿色 | |
| 3 | 2.0 | 较多、绿色 | 3 | 75 | 较多、绿色 | |
| 4 | 1.6 | 较少、绿色 | 4 | 80 | 较多、绿色(少量褐色) |
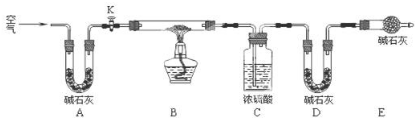
查看答案和解析>>
科目: 来源: 题型:填空题
| 品名 | ××× |
| 配料 | 鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、食盐、柠檬汁等 |
| 保质期 | 240天 |
| 生产日期 | 标于包装袋封口上 |
| 织物 | ① | ② | ③ |
| 灼烧时 的气味 | 烧焦羽毛 的气味 | 烧纸的气味 | 特殊的气味 |
查看答案和解析>>
科目: 来源: 题型:实验题
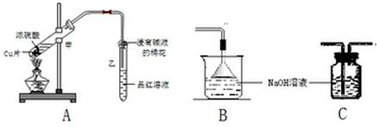
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 凡需要加热的反应一定是吸热反应 | |
| B. | 反应物的总能量不一定比生成物的总能量高 | |
| C. | 化学反应速率的大小主要取决于反应进行时的外界因素 | |
| D. | 催化剂都能加大化学反应速率,并提高原料的利用率和转化率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用排水集气法收集氨气 | |
| B. | 用分液漏斗分离水与乙醇的混合物 | |
| C. | 用淀粉溶液检验溶液中是否存在碘单质 | |
| D. | 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com