
科目: 来源: 题型:选择题
| A. | ①⑦ | B. | ①③⑥ | C. | ①⑥⑦⑧ | D. | ①②⑤⑦ |
查看答案和解析>>
科目: 来源: 题型:填空题
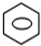 +HNO3(浓)$→_{55℃-60℃}^{浓硫酸}$
+HNO3(浓)$→_{55℃-60℃}^{浓硫酸}$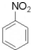 +H2O
+H2O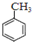 )的一氯取代物共有种4,请写出其中任意两种的结构简式
)的一氯取代物共有种4,请写出其中任意两种的结构简式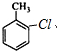 或
或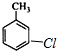 、
、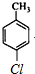 或
或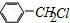 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子式为C4H10OH的醇,其结构可能有5种 | |
| B. | 乙烷与氯气在光照条件下反应的有机物共有6种 | |
| C. | 苯既能使溴的四氯化碳溶液褪色,又能在铁催化下与夜溴发生取代反应 | |
| D. | 相同质量的甲烷和乙烷完全燃烧甲烷耗氧量多 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 提倡人们购物时减少使用塑料袋,是为了减少白色污染 | |
| B. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应进行集中填埋处理 | |
| D. | 硫氧化物和氮氧化物是形成酸雨的主要物质 |
查看答案和解析>>
科目: 来源: 题型:推断题
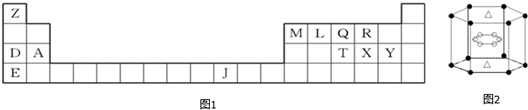
 ,XY2分子是极性分子(填“极性分子”或“非极性分子”);QY3分子中Q采用sp3杂化.
,XY2分子是极性分子(填“极性分子”或“非极性分子”);QY3分子中Q采用sp3杂化.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠隔绝空气和水蒸气 | |
| B. | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 | |
| C. | 滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3. | |
| D. | 钠长期暴露在空气中的产物是Na2CO3,原因是钠与氧气生成的Na2O与水和二氧化碳反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳棒上放出氯气 | B. | 铁钉上放出氢气 | C. | 碳棒上放出氧气 | D. | 铁钉锈蚀 |
查看答案和解析>>
科目: 来源: 题型:解答题
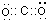 ;一种由B、C组成的化合物与AC2互为等电子体,其分子式为N2O,其结构式为O=N=N.
;一种由B、C组成的化合物与AC2互为等电子体,其分子式为N2O,其结构式为O=N=N. ,E的基态原子的简化电子排布式是[Ar]3d54s1.ECl3形成的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3.
,E的基态原子的简化电子排布式是[Ar]3d54s1.ECl3形成的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3.查看答案和解析>>
科目: 来源: 题型:解答题
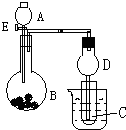 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com