
科目: 来源: 题型:选择题
 八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如图所示,下列关于莽草酸的说法正确的是( )
八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如图所示,下列关于莽草酸的说法正确的是( )| A. | 莽草酸的分子之间可能发生酯化反应 | |
| B. | 莽草酸的分子式为C7H4O5 | |
| C. | 莽草酸中含有苯环 | |
| D. | 莽草酸不能使溴水褪色 |
查看答案和解析>>
科目: 来源: 题型:解答题
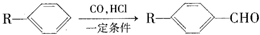 为合成某种液晶材料的中间体M,有人提出如下不同的合成路径:
为合成某种液晶材料的中间体M,有人提出如下不同的合成路径: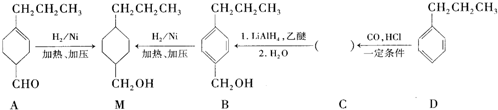
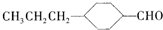 和
和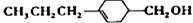 (写结构简式)生成.
(写结构简式)生成.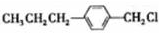 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
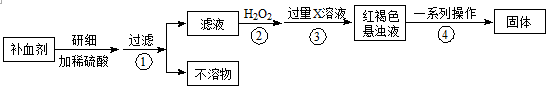
 某同学欲做1-氯丁烷的水解实验,并检验其中的氯元素.实验过程如下:(如图所示)在大试管中加入5mL 1mol•L-1 NaOH溶液和5mL的1-氯丁烷(1-氯丁烷的沸点为77~78℃,密度为0.886g•cm-3,易燃).水浴加热该试管10min以上,并控制加热温度在70~80℃.取两支小试管,各加入约1mL由2%的AgNO3和3mol•L-1硝酸按1:1比例组成的混合溶液,用胶头滴管吸取加热后大试管内的上层溶液,将此待测液逐滴加入其中一支小试管中,与另一支未加待测液的小试管内溶液相比,有白色的浑浊物出现,说明1-氯丁烷与NaOH溶液反应有Cl-生成,从而证明了1-氯丁烷中含有氯元素.请回答:
某同学欲做1-氯丁烷的水解实验,并检验其中的氯元素.实验过程如下:(如图所示)在大试管中加入5mL 1mol•L-1 NaOH溶液和5mL的1-氯丁烷(1-氯丁烷的沸点为77~78℃,密度为0.886g•cm-3,易燃).水浴加热该试管10min以上,并控制加热温度在70~80℃.取两支小试管,各加入约1mL由2%的AgNO3和3mol•L-1硝酸按1:1比例组成的混合溶液,用胶头滴管吸取加热后大试管内的上层溶液,将此待测液逐滴加入其中一支小试管中,与另一支未加待测液的小试管内溶液相比,有白色的浑浊物出现,说明1-氯丁烷与NaOH溶液反应有Cl-生成,从而证明了1-氯丁烷中含有氯元素.请回答:查看答案和解析>>
科目: 来源: 题型:填空题
 .
.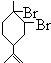 、
、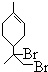 .(用键线式表示)
.(用键线式表示)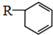 (R代表烃基),可能的结构共有4种.
(R代表烃基),可能的结构共有4种.查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 属于芳香化合物 | B. | 具有酯类化合物的性质 | ||
| C. | 属于烃 | D. | 在一定条件下可以发生加成反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
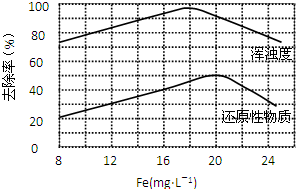 FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:
FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
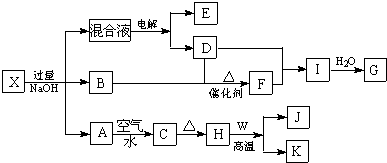
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com