
科目: 来源: 题型:选择题
| A. | 0.02mol/(L•s) | B. | 1.8mol(L•s) | C. | 1.2mol/(L•s) | D. | 0.18mol/(L•s) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 催化剂可以使不起反应的物质发生反应 | |
| C. | 升温可让吸热反应加快速率,而会让放热反应减慢速率 | |
| D. | 通过增大浓度、升高温度、增大压强都可以使反应速率加快 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 安静燃烧,火焰呈淡蓝色 | 气体成分为氢气 |
| 实验Ⅲ | 将实验Ⅰ中的白色不溶物滤出、洗涤,取少量加入足量稀盐酸 | 产生气泡沉淀全部溶解 | 白色不溶物中含有MgCO3 |
| 实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适量CaCl2或BaCl2稀溶液 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO${\;}_{3}^{2-}$ |
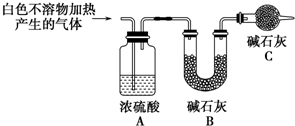
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 46 g钠与氧气完全反应生成Na2O和Na2O2,转移电子数可能为3NA | |
| B. | 向含2 mol FeI2的溶液中通入足量Cl2,消耗氯气分子数为NA | |
| C. | 2 mol Cu与足量硫粉完全反应,转移电子数为2NA | |
| D. | 1 mol Al2Fe(SO4)4固体中含Fe3+的数目为NA |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
 某有机物的结构简式如图,取Na、NaOH、新制Cu(OH)2分别与等物质的量的该物质恰好反应(反应时可加热煮沸)则Na、NaOH、新制Cu(OH)2三种物质的物质的量之比为( )
某有机物的结构简式如图,取Na、NaOH、新制Cu(OH)2分别与等物质的量的该物质恰好反应(反应时可加热煮沸)则Na、NaOH、新制Cu(OH)2三种物质的物质的量之比为( )| A. | 6:4:5 | B. | 4:6:5 | C. | 2:3:2 | D. | 2:1:2 |
查看答案和解析>>
科目: 来源: 题型:推断题
 $→_{FeCl_{3}}^{Cl_{2}}$分离得A$→_{过氧化苯甲酰}^{NBS}$
$→_{FeCl_{3}}^{Cl_{2}}$分离得A$→_{过氧化苯甲酰}^{NBS}$ $\stackrel{NaCN}{→}$B$→_{50%NaOH}^{CH_{3}CHClCH_{3}}$
$\stackrel{NaCN}{→}$B$→_{50%NaOH}^{CH_{3}CHClCH_{3}}$ $→_{②SOCl_{2}}^{①H+}$C
$→_{②SOCl_{2}}^{①H+}$C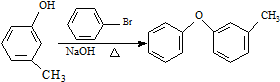 $→_{Co(OAc)_{2}}^{O_{2}}$
$→_{Co(OAc)_{2}}^{O_{2}}$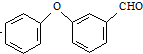 $→_{H+}^{NaCN}$D
$→_{H+}^{NaCN}$D +HCl
+HCl 中的官能团有醚键和醛基(填名称).
中的官能团有醚键和醛基(填名称).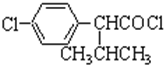 ;合成3中的有机反应类型为取代反应.
;合成3中的有机反应类型为取代反应. .
. )合成一种抗早产药的重要中间体.根据已有知识并结合相关信息,写出以CH3Br和
)合成一种抗早产药的重要中间体.根据已有知识并结合相关信息,写出以CH3Br和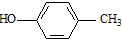 为有机原料(无机试剂和反应条件任选)合成E的路线流程图.合成路线流程图示例如下:CH2═CH2$→_{催化剂}^{O_{2}}$CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH.
为有机原料(无机试剂和反应条件任选)合成E的路线流程图.合成路线流程图示例如下:CH2═CH2$→_{催化剂}^{O_{2}}$CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH.查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com