
科目: 来源: 题型:解答题

| 离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀pH | 1,9 | 7.0 | 6,7 |
| 沉淀完全pH | $\frac{3}{4}$ | 9.0 | 10.0 |
查看答案和解析>>
科目: 来源: 题型:解答题
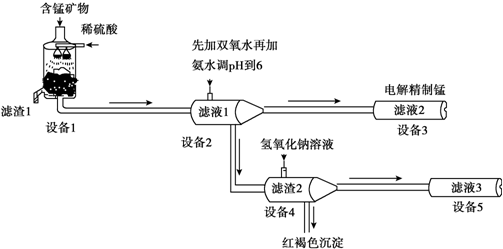
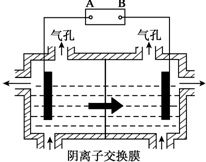 (5)设备3中用阴离子膜法提取金属锰的电解装置如图:
(5)设备3中用阴离子膜法提取金属锰的电解装置如图:查看答案和解析>>
科目: 来源: 题型:实验题
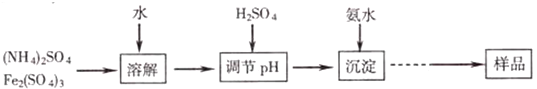
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
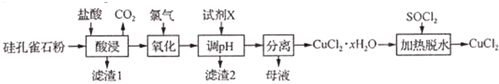
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 0.lmol•L-lNaHC2O4溶液(pH=5.5):c(Na+)>c( HC2O4-)>c(H2C2O4)>c(C2O42- ) | |
| B. | 0.lmol•L-1NaHS 溶液:C(OH-)+c(S2-)=c( H+)+c(H2S) | |
| C. | 0.lmol•L-1CH3COOH 溶液和 0.lmol•L-1CH3COONa 溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c( OH-) | |
| D. | 0.lmol•L-lNH4HSO4 溶液中滴加 0.lmol•L-1NaOH 溶液至中性:c(Na+ )>c(SO42- )>c(NH4+ )>c(OH-)=c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | FeS2$\stackrel{煅烧}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{O_{2}}{→}$Na2O2 | |
| C. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq)$\stackrel{NaOH(aq)}{→}$Fe(OH)2$\stackrel{空气中灼烧}{→}$Fe2O3 | |
| D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Cu与浓硝酸反应制 NO2:Cu+4HNO3(浓)═Cu2++2 NO3-+NO2↑+2H2O | |
| C. | 向同浓度的NaOH和Na2CO3,的混合液中加少量稀盐酸:CO32-+2H+═CO2↑+3H2O | |
| D. | 将 NaHSO4与 Ba(OH)2溶液混合至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol•L -1AgNO3,溶液:H+、K+、SO42-、I- | |
| B. | c( H+ )/c( OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 由水电离的 c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | 甲基橙呈红色的溶液中:Na+、CO32-、Fe3+、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4Br的电子式: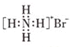 | |
| B. | 葡萄糖的结构简式:C6H12O6 | |
| C. | 水分子的比例模型: | |
| D. | 原子核内有18个中子的氣原子:1735Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com