
科目: 来源: 题型:选择题
| A. | K+、Cl-、MnO4-、SO42- | B. | Na+、SiO32-、NO3-、CO32- | ||
| C. | Na+、NO3-、SO42-、HCO3- | D. | Mg2+、SO42-、NO3-、Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,金属铝的熔点较低 | |
| B. | 铝与Fe2O3发生铝热反应后固体的质量不变 | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | Al、HCl、NaOH中任意两种物质在一定条件下均能发生反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在酒精灯加热条件下,Na2CO3、NaHCO3固定都能发生分解 | |
| B. | 不可用元素周期律解释热稳定性:Na2CO3>NaHCO3 | |
| C. | 分别加热Na2CO3和NaHCO3固体,试管内壁均有水珠,则两种物质均受热分解 | |
| D. | 1L0.1mol•L-1NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将氯化铝溶液滴入浓氢氧化钠溶液中,立刻产生大量白色沉淀 | |
| B. | Al2O3和MgO均可与NaOH溶液反应 | |
| C. | A1Cl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 常温下,Al(OH)3既能与NaOH溶液反应又能与稀硫酸反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入固体硫酸钠 | B. | 滴加几滴硫酸铜溶液 | ||
| C. | 升高稀硫酸温度 | D. | 加入硫酸钠溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | y=x | B. | y=1-x | C. | y=x-0.5 | D. | y=1-x<0.5 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 操作 | 现象 |
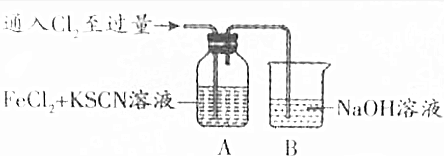 | Ⅰ.装置A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
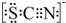
查看答案和解析>>
科目: 来源: 题型:选择题
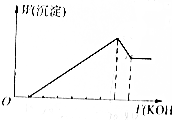 把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )
把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )| A. | 1:1 | B. | 8:9 | C. | 4:3 | D. | 4:9 |
查看答案和解析>>
科目: 来源: 题型:解答题
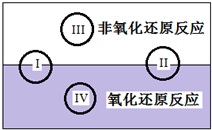 氧化还原反应在生产、生活中具有广泛的用途.请回答下列问题:
氧化还原反应在生产、生活中具有广泛的用途.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com