
科目: 来源: 题型:选择题
| A. | C2H5OH(CH3COOH),加足量CaO,蒸馏 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | KNO3晶体(NaCl),蒸馏水,结晶 | |
| D. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 哈伯法合成氨是吸热反应,新法合成氨是放热反应 | |
| B. | 新法合成和哈伯法相比不需要在高温条件下,可节约大量能源,具有发展前景 | |
| C. | 新法合成能在常温下进行是因为不需要断裂化学键 | |
| D. | 新的催化剂升高了反应所需要的能量,提高了活化分子百分数 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AgNO3 | B. | BaCl2 | C. | NaOH | D. | Ba(OH)2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 溴(水) | 乙醇 | 蒸馏 |
| D | 乙醇(水) | 新制生石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:推断题

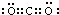 、
、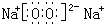 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铝能够稳定存在于空气中,而铁很容易生锈,说明铁比铝活泼 | |
| B. | 明矾(KAl (SO4)2•12H2O)可用于净水 | |
| C. | 二者对应的氧化物均为碱性氧化物 | |
| D. | Fe3O4是一种红棕色粉末,俗称磁性氧化铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com