
科目: 来源: 题型:实验题
| 实验 编号 | 实验目的 | T/K | pH | c/10-3 mol/L | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参考 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | 3 | 6.0 | 0.30 |
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
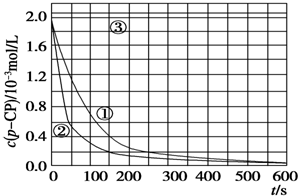 [数据处理]
[数据处理]查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaCN和HCN 1:1组成的溶液呈酸性 | |
| B. | 0.1mol•l-1的NaF、NaNO2、NaCN溶液的pH逐渐增大 | |
| C. | 根据两个反应即可得出这三种酸的电离常数数值 | |
| D. | K(HCN)<K(HNO2)<K(HF) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稀盐酸与稀醋酸的导电性 | |
| B. | 物质的量浓度相等的 (NH4)2Fe(SO4)2溶液和 (NH4)2SO4溶液中NH4+的浓度 | |
| C. | 用量筒量取液体时,仰视的读数和俯视的读数 | |
| D. | 物质的量浓度相等的NaHCO3溶液和Na2CO3溶液中水的电离程度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入铝片立即放出氢气的溶液中:C1-、K+、NH4+、NO3- | |
| B. | 滴加石蕊试液呈红色的溶液中:CO32-、K+、ClO-、OH- | |
| C. | pH=13的溶液中:HCO3-、Na+、NO3-、SO42 | |
| D. | 在pH=3的溶液中:NH4+、Ca2+、C1-、K+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol/L HR溶液与0.1mol/L氨水等体积反应,所得溶液呈酸性 | |
| B. | NaR晶体用蒸馏水配成水溶液,PH试纸测得PH大于7 | |
| C. | 将PH=2.3的HR溶液加蒸馏水稀释10倍,PH变成2.8 | |
| D. | 常温下,0.1mol/L HR溶液的pH为2 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
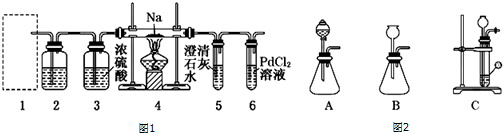
查看答案和解析>>
科目: 来源: 题型:实验题
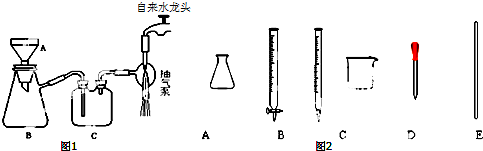
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘 | |
| B. | 当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 | |
| C. | 蒸馏操作时,温度计水银球的位置应在蒸馏烧瓶的支管口处 | |
| D. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com