
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:推断题
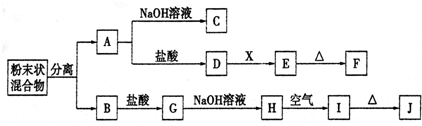
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
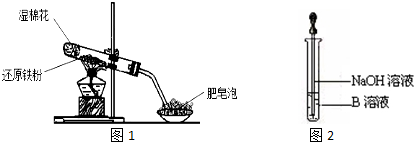
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应 CO32-+2H+=CO2↑+H2O | |
| B. | 铁钉放入硫酸铜溶液中 Fe+3Cu2+=2Fe3++3Cu | |
| C. | 氢氧化铜和硫酸反应 OH-+H+=H2O | |
| D. | 硫酸和氯化钡溶液反应 Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目: 来源: 题型:选择题
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A. | H2SO4浓度为2.5 mol•L-1 | |
| B. | OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | |
| C. | 第二份溶液中最终溶质为FeSO4 | |
| D. | 原混合酸中NO3-物质的量为0.1 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 20% | B. | 23.7% | C. | 25% | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com