
科目: 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②③ | D. | ①⑤ |
查看答案和解析>>
科目: 来源: 题型:解答题
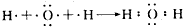 .
. (3)A、B、C三种元素能形成多种化合物.某化合物甲一分子中含有一个氧原子,相对分子质量为46,其存在如图转化关系:
(3)A、B、C三种元素能形成多种化合物.某化合物甲一分子中含有一个氧原子,相对分子质量为46,其存在如图转化关系: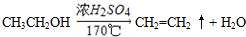 ;
;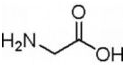 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每消耗1mol Na2CO3就会放出22.4LCO2 | |
| D. | 每生成1molNa2S2O3,转移4mol电子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 2.0gH218O与D2O的混合物中所含中子数为NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| B. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| C. | Na2O2可用作呼吸面具中的供氧剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 既是氧化剂又是还原剂,CuSO4只是还原剂 | |
| B. | Cu3P既是氧化产物又是还原产物 | |
| C. | 1 mol CuSO4可以氧化$\frac{1}{5}$mol P | |
| D. | 若有11 mol P参加反应,转移电子的物质的量为60 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+ | |
| B. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 | |
| C. | 反应3NO2+H2O═2HNO3+NO中氧化剂和还原剂的物质的量之比是3:1 | |
| D. | 在反应CaH2+2H2O═Ca(OH)2+2H2↑中,水作氧化剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将氢氧化铁溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com