
科目: 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫酸铝溶液中加入足量氨水:Al3++4OH-═AlO${\;}_{2}^{-}$+2H2O | |
| C. | FeSO4溶液与稀硝酸反应:3Fe2++NO${\;}_{3}^{-}$+4H+═3Fe3++NO↑+2H2O | |
| D. | 碳酸氢铵和足量氢氧化钠溶液反应:NH${\;}_{4}^{+}$+OH-═NH3•H2O |
查看答案和解析>>
科目: 来源: 题型:推断题
 ;
;查看答案和解析>>
科目: 来源: 题型:实验题
| 实验 序号 | 碳酸钙 状态 | c(HCl) /mol•L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 粒状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 粒状 | 0.6 | 20 | 41 | 280 |
| 4 | 粒状 | 0.8 | 20 | 40 | 200 |
| 5 | 粉末 | 0.8 | 20 | 40 | 30 |
| 6 | 粒状 | 1.0 | 20 | 40 | 120 |
| 7 | 粒状 | 1.0 | 30 | 50 | 40 |
| 8 | 粒状 | 1.2 | 20 | 40 | 90 |
| 9 | 粒状 | 1.2 | 25 | 45 | 40 |
查看答案和解析>>
科目: 来源: 题型:实验题
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液的酸碱性①对反应速率的影响.在常温下按照如表方案完成实验.| 编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5% 5H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 甲 | BaCl2 | HCl | Cu(NO3)2 |
| 乙 | Fe2O3 | K2SO4 | H2SO4 |
| 丙 | Fe | NaOH | MgCl2 |
查看答案和解析>>
科目: 来源: 题型:填空题
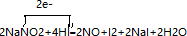 .
.查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:多选题

| A. | 该过程中有极性键的断裂和形成 | B. | 该过程中的X和Y均为活化分子 | ||
| C. | 加入催化剂能增大X和Y分子的能量 | D. | 该过程不能消除大气污染物 |
查看答案和解析>>
科目: 来源: 题型:选择题
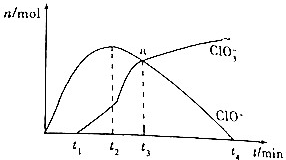 工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分为NaClO),某化学小组在一定温度下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO${\;}_{3}^{-}$的物质的量(mol)与反应时间t(min)的关系如图所示.下列说法错误的是( )
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分为NaClO),某化学小组在一定温度下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO${\;}_{3}^{-}$的物质的量(mol)与反应时间t(min)的关系如图所示.下列说法错误的是( )| A. | 参加反应所需要NaOH与氯气的物质的量之比一定为2:1 | |
| B. | a点时溶液中n(NaCl):n(NaClO3):n(NaClO)=6:1:1 | |
| C. | t2~t4min,ClO-的物质的量下降的原因可能是3ClO-═2Cl-+ClO${\;}_{3}^{-}$ | |
| D. | 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
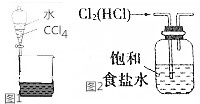 下列关于物质的分离提纯不正确的是( )
下列关于物质的分离提纯不正确的是( )| A. | 用如图1所示装置分离CCl4和水 | |
| B. | 除去苯中的少量苯酚,加入适量浓溴水,过滤 | |
| C. | 实验室用如图2所示装置除去Cl2中的少量HCl | |
| D. | 除去O2中混有得得少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com