
科目: 来源: 题型:多选题
| A. | DMC的结构简式为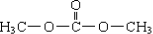 | |
| B. | DMC在空气不能燃烧 | |
| C. | DMC易溶于水,不溶于乙醇和丙酮 | |
| D. | DMC用于生产非毒性化工产品,故被誉为有机合成的“绿色化工原料” |
查看答案和解析>>
科目: 来源: 题型:推断题
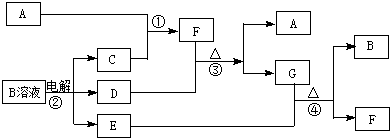
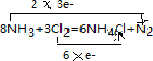 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④ | B. | ①②③ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子总数 | B. | 质子总数 | C. | 电子总数 | D. | 质量 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Ba(OH)2?Ba2++2 OH- | B. | H3PO4?3 H++PO43- | ||
| C. | NaHCO3═Na++H++CO3 2- | D. | HClO?H++ClO- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 20:1 | B. | 1:20 | C. | 10:1 | D. | 1:10 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.01mol•L-1 H2SO4 | B. | pH=2的H2SO4溶液 | ||
| C. | c(OH-)=10-13mol•L-1 | D. | pH=1溶液加水稀释1倍 |
查看答案和解析>>
科目: 来源: 题型:解答题
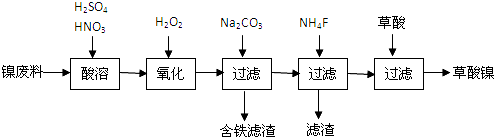
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com