
科目: 来源: 题型:选择题
| A. | 原子序数为92 | B. | 质子数为92 | C. | 电子数为92 | D. | 中子数为92 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 据图可知,阳极反应式为2SO42--4e-=2SO3↑+O2↑ | |
| B. | 阳极失去2mol电子时,理论上可以得到11.2L氧气 | |
| C. | SO2在阴极与O2反应生成硫酸根,则方程式为SO2+O2+2e-=SO42- | |
| D. | CO2不参与电极反应,净化器中CO2浓度升高 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向0.1mol/LpH=2的HF溶液加水稀释,$\frac{c({H}^{+})}{c(HF)}$增大 | |
| B. | 向0.2 mol/L NaHCO3溶液中加入等体积0.1 mol/L NaOH溶液c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | 向0.1mol/L NaHSO3溶液中通入NH3至中性(溶液体积视为不变),则 c(NH4+)+c(H2SO3)═c(SO32-) | |
| D. | 现有常温下水电离出的c(H+)均为1×10-11 mol/L且体积相同的三种溶液:①HCl溶液②CH3COOH溶液③NaOH溶液,分别与足量铝粉反应,生成氢气的量③最少 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol OH-中含有9NA个电子 | |
| B. | 28 g CO气体中含有NA个氧原子 | |
| C. | 1 mol/L AlCl3溶液中含有NA个Al3+ | |
| D. | 常温常压下,11.2 L甲烷气体中含有的分子数为0.5NA |
查看答案和解析>>
科目: 来源: 题型:填空题
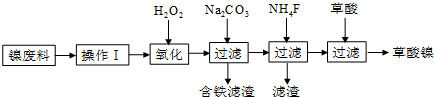
查看答案和解析>>
科目: 来源: 题型:实验题
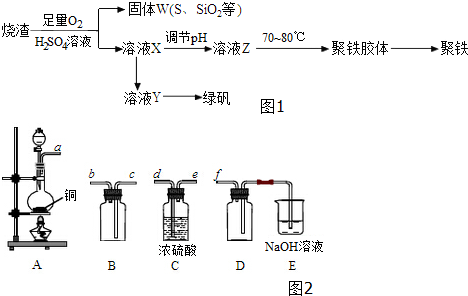
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸与醇反应一定能生成酯,且酯化反应是可逆反应 | |
| B. | CO2通入饱和苯酚钠溶液,用分液法可以得到苯酚 | |
| C. | 有机物 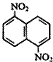 的n溴代物的同分异构体的数目与m溴代物的同分异构体的数目相等,则m、n一定满足的关系式m+n=6 的n溴代物的同分异构体的数目与m溴代物的同分异构体的数目相等,则m、n一定满足的关系式m+n=6 | |
| D. | 等物质的量的烃或烃的含氧衍生物A和B完全燃烧时,消耗氧气的量相等.则A和B的分子量相差可能为18n或44n(n为正整数) |
查看答案和解析>>
科目: 来源: 题型:填空题
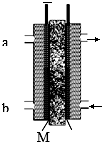 甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:
甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极.图是甲醇燃料电池模型,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com