
科目: 来源: 题型:解答题
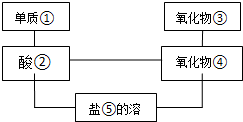 给图中①~⑤选择适当的物质,使有连线的两物质能发生反应.供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉.
给图中①~⑤选择适当的物质,使有连线的两物质能发生反应.供选择的试剂有稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉.查看答案和解析>>
科目: 来源: 题型:实验题
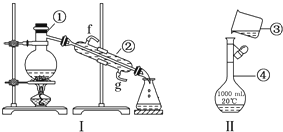
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
| 分子 | a | 孤对电子数 | δ键数 | VSEPR模型 | 空间构型 |
| CO2 | 4 | 0 | 2 | 直线形 | 直线形 |
| SO2 | 6 | 1 | 2 | 四面体 | V形 |
| NH3 | 5 | 1 | 3 | 四面体 | 三角锥形 |
| CCl4 | 4 | 0 | 4 | 正四面体 | 正四面体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第2周期元素的第一电离能随原子序数递增依次增大 | |
| B. | 氟元素的电负性最大 | |
| C. | CO2、SO2都是直线形的非极性分子 | |
| D. | CH2═CH2分子中共有四个σ键和一个π键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2H++2e-=H2↑ | B. | Fe=Fe2++2e- | ||
| C. | 2H2O+O2+4e-=4OH- | D. | 4OH-=2H2O+O2↑+4e- |
查看答案和解析>>
科目: 来源: 题型:解答题
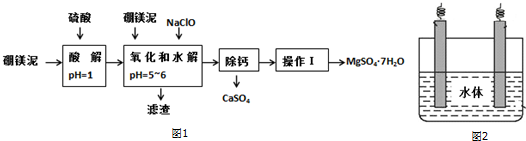
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目: 来源: 题型:实验题
| 步骤 | 现象 |
| ⅰ.向盛有30mL 0.2mol•L-1 KI溶液的锥形瓶中依次 滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为 蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |

查看答案和解析>>
科目: 来源: 题型:解答题
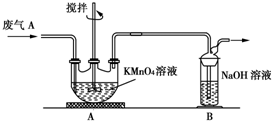 ①为了保证实验成功,装置A应具有的现象是KMnO4溶液的紫红色不能完全褪色,搅拌的目的是提高SO2的吸收率.
①为了保证实验成功,装置A应具有的现象是KMnO4溶液的紫红色不能完全褪色,搅拌的目的是提高SO2的吸收率.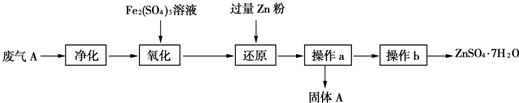
查看答案和解析>>
科目: 来源: 题型:实验题
| 假设 | 实验验证方法及现象 | |
| 假设1 | 白色浑浊物是BaSO3 | (1)在白色浑浊物中加入过量盐酸,会变澄清 |
假设2 | (2)白色浑浊物是BaSO4,主要 原因是Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4 | 反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中,不出现浑浊.滴加FeCl3溶液后出现浑浊; (3)通入纯净的CO2的目的防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com