
科目: 来源: 题型:选择题
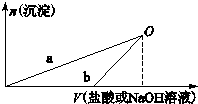 某同学研究铝及其化合物的性质时设计了如下两个实验方案:
某同学研究铝及其化合物的性质时设计了如下两个实验方案:| A. | b曲线表示的是向X溶液中加入NaOH溶液 | |
| B. | 在O点时两方案中所得溶液浓度相等 | |
| C. | a、b曲线表示的反应都是非氧化还原反应 | |
| D. | X溶液显酸性,Y溶液显碱性 |
查看答案和解析>>
科目: 来源: 题型:解答题
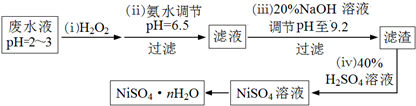
查看答案和解析>>
科目: 来源: 题型:解答题
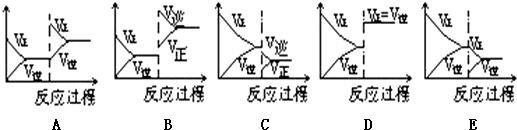
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | A B E H J | B. | B E I J | C. | E H J | D. | F H J |
查看答案和解析>>
科目: 来源: 题型:实验题
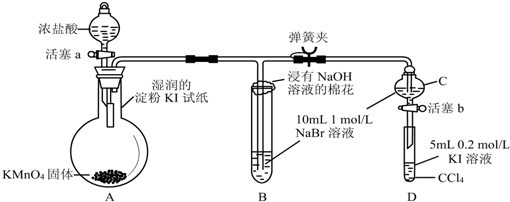
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
 某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).
某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验).查看答案和解析>>
科目: 来源: 题型:选择题
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol/L) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol/(L•min) | |
| B. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| C. | 升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3的$\frac{△n({T}_{1})}{△n({T}_{2})}$<1 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题
 回答以下问题:
回答以下问题:| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 配制500mL 4.6mol/L的稀硫酸需取该硫酸125mL | |
| C. | 1mol Cu与足量的该硫酸反应产生2g氢气 | |
| D. | 等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com