
科目: 来源: 题型:解答题
| W | 氮 | Y | |
| X | 硫 | Z |
 ;写出工业生产X单质粗产品的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO.
;写出工业生产X单质粗产品的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1L 0.1mol/L AlCl3溶液中含有的离子数是0.4NA | |
| B. | 3.9g Na2O2吸收足量的CO2时转移的电子数是0.05NA | |
| C. | 1L 1.0mol/L NaCl溶液中含有NA个NaCl分子 | |
| D. | 标准状况下,1.12L的SO3所含的原子数是0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯气溶于水的离子方程式:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,若溶液变成蓝色,则氧化性:Cl2>I2 | |
| C. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| D. | 漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原溶液中投入铁粉的物质的量是0.2mol | |
| B. | 原溶液中HNO3的浓度是1.5mol | |
| C. | 反应后的溶液中还可溶解7.2g铜 | |
| D. | 反应后的溶液中c(Fe2+):c(Fe3+)=1:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | B. | N2+3H2$?_{催化剂}^{高温、高压}$2NH3 | ||
| C. | Mg+Cl2$\frac{\underline{\;点燃\;}}{\;}$MgCl2 | D. | NaHCO3+HCl=NaCl+CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:实验题
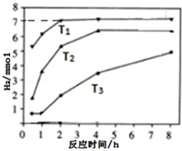 天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)等],可以用氢氧化钠溶液洗涤除去.羰基硫用氢氧化钠溶液处理的过程如下(部分产物已略去):
天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)等],可以用氢氧化钠溶液洗涤除去.羰基硫用氢氧化钠溶液处理的过程如下(部分产物已略去):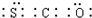 .反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O.
.反应I除生成两种正盐外,还有水生成,其化学方程式为COS+4NaOH=Na2S+Na2CO3+2H2O.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1 mol CH4所含共价键的数目为NA | |
| B. | 1 mol Cu和2 mol 浓硫酸反应转移电子数目为2 mol | |
| C. | 标准状况下,22.4 L乙烯在氧气中完全燃烧后,所得到的气态物质的分子数目为4NA | |
| D. | 0.5mol C2H6中含有的非极性共价键数目为0.5NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲醇发生氧化反应 | |
| B. | O2在电极上得电子,被还原 | |
| C. | 电池工作时,甲醇电极反应式:CH3OH-6e-+H2O=CO2↑+6H+ | |
| D. | 该电池的甲醇燃料并没有储存在电池内部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com