
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 第一组 | A-268.8 | B-249.5 | C-185.8 | D-151.7 |
| 第二组 | F2-187.0 | Cl2-33.6 | Br2 58.7 | I2 184.0 |
| 第三组 | HF 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| 第四组 | H2O 100.0 | H2S-60.2 | H2Se-42.0 | H2Te-1.8 |
| A. | 第四组物质中H2O的沸点最高,是因为H2O分子之间存在氢键 | |
| B. | 第三组与第四组相比较,化合物的稳定性顺序为:HBr>H2Se | |
| C. | 第二组物质,单质的氧化性:F2>Cl2>Br2>I2 | |
| D. | 第一组物质是分子晶体,一定含有共价键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | N2、H2不再化合 | |
| B. | N2、H2、NH3的质量相等 | |
| C. | N2、H2、NH3浓度不再变化 | |
| D. | 改变条件,N2、H2、NH3的浓度也不再变化 |
查看答案和解析>>
科目: 来源: 题型:实验题
 (1)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸.按要求回答下列问题:
(1)已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、Fe2(SO4)3溶液、盐酸.按要求回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 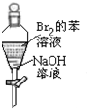 充分振荡后静置,上层溶液颜色保持不变 | |
| B. | 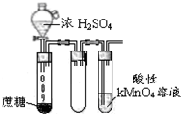 酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| C. | 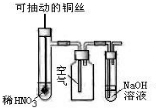 微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 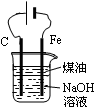 制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4 NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 18gD2O中含有的中子数为10 NA(设NA为阿伏加德罗常数的数值) | |
| C. | 明矾既可以用于净水,又可杀菌消毒 | |
| D. | 恒温恒容下,某可逆反应X(g)+Y(g)?Z(g)+W(s)△H>0达平衡后再加入X,该反应的△H不变 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
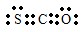 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 萃取碘水中的碘时,将碘水倒入分液漏斗,然后再注入酒精,震荡静置后下层液体下口出,上层液体上口出 | |
| B. | 在蔗糖溶液中加入几滴稀硫酸,水浴加热5 min,加入NaOH溶液至碱性,再加入银氨溶液并水浴加热 | |
| C. | 将Fe(NO3)2固体溶于稀硫酸后,滴加KSCN溶液,溶液变红,说明已经Fe(NO3)2变质 | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤干燥 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com