
科目: 来源: 题型:选择题
| A. | 油脂水解均可得到葡萄糖 | B. | 可用碘检验淀粉是否完全水解 | ||
| C. | 蛋白质水解可得到高级脂肪酸 | D. | 纤维素在人和动物体内都可水解 |
查看答案和解析>>
科目: 来源: 题型:推断题
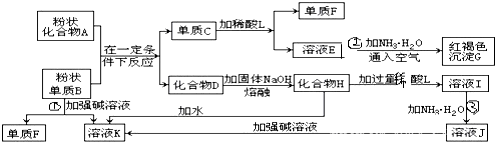
查看答案和解析>>
科目: 来源: 题型:实验题
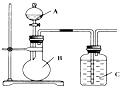 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律.查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应②中除掉的杂质离子是Fe2+和Mn2+ | |
| B. | 步骤②加高锰酸钾前若PH较低则Fe2+和Mn2+不能除去 | |
| C. | 反应③的类型为置换反应,滤渣中含有锌和镍 | |
| D. | 反应④中的产物成分可能是ZnCO3.xZn(OH)2若得到干燥滤饼22.4克,煅烧后可得到产品16.2克,则X=2 |
查看答案和解析>>
科目: 来源: 题型:选择题
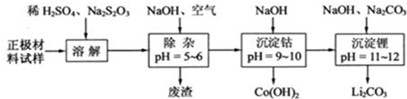
| A. | 在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中发生的反应8LiCoO2+Na2S2O3+11H2SO4═4 Li2SO4+8CoSO4+Na2SO4+11H2O | |
| B. | 调整pH=5-6的目的是使Fe3+、Al3+转化为Fe(OH)3、Al(OH)3除去 | |
| C. | Co(OH)2沉淀完全后,溶液中不存在Co2+ | |
| D. | Li与Mg在周期表中处于对角线位置,性质有相似性,因此单质Li可用电解法回收 |
查看答案和解析>>
科目: 来源: 题型:选择题
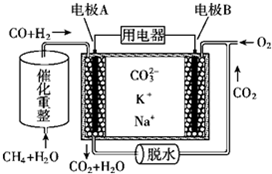
| A. | 电池工作时,K+向B极移动 | |
| B. | 电极B上发生的电极反应:O2+2CO2+4e-═2CO32- | |
| C. | 电池工作时,CO2可以循环利用 | |
| D. | 消耗1molCH4催化重整得到的CO和H2通入电极A,需要电极B同时通入33.6L的O2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲苯的一氯取代物有三种同分异构体,它们的熔沸点各不相同 | |
| B. | CH2O2和C2H4O2分子组成上相差一个CH2,所以互为同系物 | |
| C. | 乙醛分别与O2,银氨溶液,新制氢氧化铜反应,均体现了乙醛的还原性 | |
| D. | 淀粉,纤维素,蛋白质都属于天然高分子化合物,可作为人体的供能物质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径 (×10-10m) | 0.37 | 1.86 | 1.43 | 0.99 | 0.75 | 0.74 | |
主要化合价 | 最高 正价 | +1 | +1 | +3 | +7 | +5 | - |
| 最低 负价 | -1 | - | - | -1 | -3 | -2 | |
| A. | H2Q的还原性和稳定性大于RH3 | |
| B. | Y、Z、M三种元素的最高价氧化物的水化物两两之间会反应 | |
| C. | 化合物XM,YM都是电解质,熔融状态下都能电解 | |
| D. | 元素Z、M组成的化合物熔化时破坏了离子键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用PH试纸测得某浓度的Na2CO3溶液的PH值为10.2 | |
| B. | 已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O,在定量测定该反应速率时,可用排水法测SO2的体积,计算反应速率 | |
| C. | 蒸发结晶时,将蒸发皿中的溶液蒸干后得到所需固体 | |
| D. | 脂皂化反应后的反应液中加入饱和食盐水并搅拌后,生成的高级脂肪酸钠浮在水面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com