
常温下,在没有氧气存在时,铁粉与水几乎不反应,但在高温下,铁粉能与水蒸气反应.
(1)铁粉与水蒸气反应的化学方程式是
.
(2)停止反应,待装置冷却后,取出反应后的混合物,加入过量的稀硫酸充分反应,过滤.简述检验所得滤液中含有Fe
3+的操作方法:
取少量滤液与试管中,滴入几滴KSCN溶液,若溶液变血红色,证明含有铁离子,否则无铁离子
取少量滤液与试管中,滴入几滴KSCN溶液,若溶液变血红色,证明含有铁离子,否则无铁离子
.
(3)经检验上述滤液中不含Fe
3+,这不能说明铁粉与水蒸气反应所得的产物中不含+3价的铁.原因是(结合化学方程式说明)
如果反应后的混合物中含有过量的铁粉,会发生反应2Fe3++Fe=3Fe2+,铁粉把铁离子全部还原为亚铁离子后滴入KSCN溶液不变红色
如果反应后的混合物中含有过量的铁粉,会发生反应2Fe3++Fe=3Fe2+,铁粉把铁离子全部还原为亚铁离子后滴入KSCN溶液不变红色
.
(4)某同学利用上述滤液制取白色的Fe(OH)
2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色.
①沉淀由白色变为红褐色的化学反应方程式是
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.
②为了得到白色的Fe(OH)
2沉淀,并尽可能较长时间保持白色沉淀,该同学设计了如图所示的装置:
请简述实验操作:
实验时先打开活塞K,再将分液漏斗的活塞打开,使稀硫酸与铁粉反应,用生成的氢气排出装置中的空气,然后关闭K,利用生成的氢气将试管中的硫酸亚铁溶液压入氢氧化钠溶液中,则可在盛氢氧化钠溶液的试剂瓶中较长时间保存白色氢氧化亚铁沉淀;
实验时先打开活塞K,再将分液漏斗的活塞打开,使稀硫酸与铁粉反应,用生成的氢气排出装置中的空气,然后关闭K,利用生成的氢气将试管中的硫酸亚铁溶液压入氢氧化钠溶液中,则可在盛氢氧化钠溶液的试剂瓶中较长时间保存白色氢氧化亚铁沉淀;
.

 某研究小组将一定质量的镁铝合金材料投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n(mol)与加入NaOH溶液的体积V(mL)的变化如图所示.
某研究小组将一定质量的镁铝合金材料投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n(mol)与加入NaOH溶液的体积V(mL)的变化如图所示. A、B、C三种物质中均含有同一种元素,它们之间有如图所示的转化关系(部分反应已略去).
A、B、C三种物质中均含有同一种元素,它们之间有如图所示的转化关系(部分反应已略去). 短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.
短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.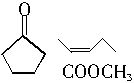
 “酒后醉驾”成为社会热点问题之一,有一种离子化合物A,可用于小汽车防撞保护气囊,加强对驾驶员的保护,其由两种元素组成,摩尔质量为65g/mol,加热时可以生成两种单质.
“酒后醉驾”成为社会热点问题之一,有一种离子化合物A,可用于小汽车防撞保护气囊,加强对驾驶员的保护,其由两种元素组成,摩尔质量为65g/mol,加热时可以生成两种单质.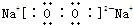
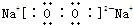



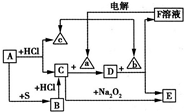 中学化学中几种常见物质的转化关系如下所示(部分反应的生成物已略去),其中A、a、c是单质,a为黄绿色气体,E为红褐色沉淀.请回答下列问题:
中学化学中几种常见物质的转化关系如下所示(部分反应的生成物已略去),其中A、a、c是单质,a为黄绿色气体,E为红褐色沉淀.请回答下列问题: X、Y、Z为中学化学常见的三种单质,它们在一定条件下可以发生如图所示的反应.其中z为绿色植物光合作用的产物之一,A、B为常见的化合物.
X、Y、Z为中学化学常见的三种单质,它们在一定条件下可以发生如图所示的反应.其中z为绿色植物光合作用的产物之一,A、B为常见的化合物.
 常温下,在没有氧气存在时,铁粉与水几乎不反应,但在高温下,铁粉能与水蒸气反应.
常温下,在没有氧气存在时,铁粉与水几乎不反应,但在高温下,铁粉能与水蒸气反应.