
科目: 来源: 题型:实验题
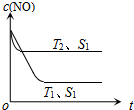 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | a>b>c | B. | a>c>b | C. | a=b+m+n | D. | a=c-n-m |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
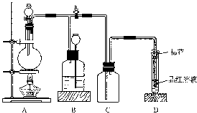 如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置:
如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | A、B、C、D、E | B. | B、A、E、D、C | C. | B、A、D、C、E | D. | C、D、A、B、E |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+ Cu2+ NO3- Cl- | B. | K+ NO3- Na+ Cl- | ||
| C. | K+ CO32- NO3- Ca2+ | D. | K+ NO3- SO42- Mg2+ |
查看答案和解析>>
科目: 来源: 题型:实验题
 (1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在100kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃),N2H4完全燃烧的热化学方程式是N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol.
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在100kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃),N2H4完全燃烧的热化学方程式是N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642kJ/mol.查看答案和解析>>
科目: 来源: 题型:实验题
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com